微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)(2012?重庆)尿素[CO(NH2)2]是首个由无机物人工合成的有机物.
(1)工业上尿素由CO2和NH3在一定条件下合成,其反应方程式为 .
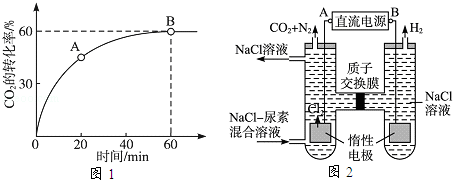
(2)当氨碳比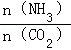 =4时,CO2的转化率随时间的变化关系如图1所示.
=4时,CO2的转化率随时间的变化关系如图1所示.
①A点的逆反应速率v逆(CO2) B点的正反应速率v正(CO2)(填“大于”“小于”或“等于”).
②NH3的平衡转化率为 .
(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图2所示.
①电源的负极为 (填“A”或“B”).
②阳极室中发生的反应依次为 、 .
③电解结束后,阴极室溶液的pH与电解前相比将 ;若两极共收集到气体13.44L(标准状况),则除去的尿素为 g(忽略气体的溶解).
参考答案:(1)2NH3+CO2 CO(NH2)2+H2O;
CO(NH2)2+H2O;
(2)①小于②30%
(3)①B②6Cl
本题解析:
本题难度:困难
2、填空题 在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间(s)
C(mol/L)
|
0
|
20
|
40
|
60
|
80
|
100
|
C(N2O4)
| 0.20
| a
| 0.10
| c
| d
| e
|
C(NO2)
| 0.00
| 0.12
| b
| 0.22
| 0.22
| 0.22
|
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。
请回答下列问题:
(1)该反应的化学方程式为?,正反应是?(填“吸热”或“放热”)反应。
(2)20s时,N2O4的的浓度为?mol/L,0~20s内N2O4的平均反应速率为?。
(3)在80℃时该反应的平衡常数K值为?(保留2位小数)。
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时?。
A、N2O4的转化率越高? B、NO2的产量越大
C、N2O4与NO2的浓度之比越大? D、正反应进行的程度越大
参考答案:(每空2分,共12分)(1)N2O4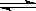 ?2NO2,吸热
?2NO2,吸热
(2)0.14, 0.003 mol/(L·s) (3)0.54 (4)ABD
本题解析:(1)N2O4分解生成NO2,反应的化学方程式是N2O4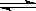 ?2NO2。根据表中数据可知,反应进行到60s时,物质到浓度不再发生变化,说明反应达到平衡状态。当反应进行到反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅,这说明降低温度反应写逆反应方向移动,因此正反应是吸热反应。
?2NO2。根据表中数据可知,反应进行到60s时,物质到浓度不再发生变化,说明反应达到平衡状态。当反应进行到反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅,这说明降低温度反应写逆反应方向移动,因此正反应是吸热反应。
(2)20s时,四氧化二氮的浓度为a
N2O4? ?2NO2
?2NO2
1mol/L?2mol/L
(0.20-a)mol/L ?0.12mol/L
解得a=0.14mol/L
则反应的N2O4浓度为(0.2-0.14)mol/L=0.06mol/L
则反应速率v(N2O4)=0.06mol/L÷20s=0.003 mol/(L·s)
(3)平衡时NO2当浓度是0.22mol/L,则N2O4的浓度是0.2mol/L-0.11mol/L=0.09mol/L
所以根据反应的方程式可知,平衡常数K=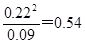
(4)根据化学平衡常数知,K越大,生成物的浓度越大,反应物的浓度越小,N2O4的转化率大、NO2的产量越大、N2O4与NO2的浓度之比越小、正反应进行的程度越大,即选项ABD正确,答案选ABD。
点评:该题是高考中的常见题型,属于综合性试题的考查。试题在注重对学生基础知识巩固和训练的同时,侧重对学生解题能力的培养和方法的指导与训练,旨在培养学生分析、归纳、总结问题的能力。有利于调动学生的学习兴趣和学习积极性,也有助于培养学生的逻辑推理能力和抽象思维能力。
本题难度:一般
3、选择题 反应A(g)+3B(g) 2C(g)(正反应为放热反应),达平衡后,将气体混合物的温度降低,下列叙述中正确的是
2C(g)(正反应为放热反应),达平衡后,将气体混合物的温度降低,下列叙述中正确的是
[? ]
A.正反应速率加大,逆反应速率变小,平衡向正反应方向移动
B.正反应速率变小,逆反应速率加大,平衡向逆反应方向移动
C.正反应速率和逆反应速率都变小,平衡向正反应方向移动
D.正反应速率和逆反应速率都变小,平衡向逆反应方向移动
参考答案:C
本题解析:
本题难度:一般
4、填空题 某反应A+B C在任意时刻的正、逆反应速率都可用v(正)、v(逆)表示,: v(正)=k1×c(A) ×c(B) v(逆)=k2×c(C),其中k1、k2在一定温度下恒为常数,c(A)、c(B)、c(C)分别代表某时刻三种物质的物质的量浓度。
C在任意时刻的正、逆反应速率都可用v(正)、v(逆)表示,: v(正)=k1×c(A) ×c(B) v(逆)=k2×c(C),其中k1、k2在一定温度下恒为常数,c(A)、c(B)、c(C)分别代表某时刻三种物质的物质的量浓度。
(1)上述反应达到平衡时,三种物质的物质的量浓度关系可表示为____________________。
(2)在300K时,开始反应的A、B的浓度均为0.1mol/L,达平衡时B的转化率为50%,则k1、k2之间的关系是____________________。
(3)升高温度k1、k2的变化是______________,k1/k2增大,说明正反应是_____________(填“放热”或 “吸热”)反应。
参考答案:(1) =
=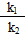
(2)k1=20k2
(3)k1,k2均变大;吸热
本题解析:
本题难度:一般
5、填空题 (20分)己知:
(1)2C(石墨s)+O2 (g) =" 2" CO(g) △H=-222KJ/mol
(g) =" 2" CO(g) △H=-222KJ/mol
(2)2 H2(g)+O2(g)="2" H2O(g) △H=-484KJ/mol
(3)C(石墨s)+O2(g)=CO2(g) △H=-393.5KJ/mo l
l
(4)H2O(g)=H2O(L) △H=-44KJ/mol
(5)C(金刚石s)+O2(g)=CO2(g) △H=-395.4KJ/mol
回答下列问题:
(1)C(石墨)的燃烧热为 。
(2)写出表示H2的燃烧热的热化学方程式:  。
。
(3)写出石墨转化为金刚石的热化学方程式(可不注明条件) 。相对更稳定的物质是 。
(4)工业上制H2的一个重要反应是:CO(g)+H2O(g)
参考答案:
本题解析:
本题难度:一般