微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (15分)现有如下两个反应:(A)NaOH + HCl =" NaCl" + H2O
(B)2FeCl3 + Cu = 2FeCl2 + CuCl2
(1)根据两反应本质,判断能否设计成原电池(填“能”或“不能”)(A) (B) 。
(2)如果(A或B)不能,说明其原因 。
(3)如果(A或B)可以,则写出正、负极材料及其电极反应式,电解质溶液
负极: ; 。
正极: ; 。
电解质溶液: 。
参考答案:(1)(A)不能(1分) (B)能 (1分)
(2)A反应是非氧化还原反应 (2分)
(3)负极:Cu(2分):Cu-2e-=Cu2+(2分)
正极:石墨(2分,其它合理答案亦可):2Fe3++2e-=2Fe2+(3分)
电解质溶液:氯化铁溶液(2分)
本题解析:(1)由于电子的定向运动形成电流,所以只有氧化还原反应才能设计成原电池,A是中和反应,表示氧化还原反应,不能设计成有点像。B是氧化还原反应,可以。
(3)根据B的总反应式可知,铜失去电子,作还原剂,所以作原电池的负极。正极材料只用金属性弱于铜即可。氯化铁得到电子,因此电解质溶液是氯化铁。
本题难度:一般
2、选择题 Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法错误的是(? )

A.Mg 电极是该电池的负极
B.溶液中Cl-向石墨电极移动
C.该装置中电子从Mg电极流向石墨电极
D.H2O2在石墨电极上发生还原反应
参考答案:B
本题解析:Mg-H2O2电池中,Mg是活泼金属作电池负极,失去电子,电子从外电路转移到石墨电极,生成的Mg2+不断进入溶液中,所以溶液中的阴离子不断往负极(Mg)移动,同时H2O2 得到电子被还原,发生还原反应。所以上述选项中只有B错误,选B。
本题难度:一般
3、选择题 某课外活动小组使用下列用品设计原电池。用品:铜片、铁片、导线、金属夹、发光二极管、果汁(橙汁、苹果汁)500mL,、烧杯。下列说法正确的是
A.该装置能将电能转化为化学能 B.实验过程中铜片逐渐溶解
C电子由铁片通过导线流向铜片 D.铁片上会析出红色的铜
参考答案:C
本题解析:略
本题难度:一般
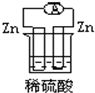
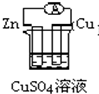
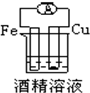
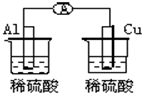
4、选择题 下列图示的装置属于原电池的是( )
A.
B.
C.
D.
参考答案:A、两电极材料相同,不能形成原电池,故A错误;
B、两电极材料不同,锌较活泼,能与硫酸铜溶液反应,形成闭合回路,所以能形成原电池,故B正确;
C、乙醇溶液不导电,不能形成原电池,故C错误;
D、该装置不能形成闭合回路,所以不能构成原电池,故D错误;
故选B.
本题解析:
本题难度:简单
5、选择题 对原电池的电极名称,下列叙述中错误的是( )
A.电子流入的一极为正极
B.比较不活泼的一极为正极
C.电子流出的一极为负极
D.发生氧化反应的一极为正极
参考答案:A、原电池中,电子从负极沿导线流向正极,所以电子流入的一极为正极,故A正确.
B、原电池中,负极上失电子发生氧化反应,正极上得电子发生还原反应,所以较活泼的金属作负极,较不活泼的电极为正极,故B正确.
C、原电池中,电子从负极沿导线流向正极,所以电子流出的一极为负极,故C正确.
D、电池中,负极上失电子发生氧化反应,正极上得电子发生还原反应,故D错误.
故选D.
本题解析:
本题难度:简单