微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是
[? ]
A.CaC2 + H2O =Ca(OH)2 + C2H2
B.NH3+CO2+H2O=NH4HCO3
C.2NaOH+Cl2=NaCl+NaClO+H2O
D.2Na2O2+2CO2=2Na2CO3+O2
参考答案:D
本题解析:
本题难度:简单
2、填空题 A、B、C、D、E、F、G七种短周期主族元素的原子序数依次增大,D、G同主族,A与B、C、D能形成电子数相同的二种常见分子,E、F的原子序数之和是D的原子序数的3倍,D、E、F的简单离子具有相同电子层结构.
(1)三种元素的名称.B______,D______,F______.
(2)A与D、A与G均可形成18e-的化合物.两种化合物在水溶液中反应的化学方程式为:______
(3)A、D、E三种元素中的两种或三种形成的物质中,含有非极性键的离子化合物的电子式为:______;只含离子键的化合物的电子式为:______.
(4)E离子的半径______(填“大于”“小于”或“等于”)?F离子的半径;E?和F元素最高价氧化物对应的水化物之间反应的离子方程式为:______.
(5)写出由上述各种元素形成的粒子中与BC-电子数相等的三种分子的化学式______、______、______.
参考答案:由短周期主族元素的原子序数依次增大,A与B、C、D能形成电子数相同的二种常见分子,由常见的10e-和18e-微粒可知,则A为氢,B为碳、C为氮、D为氧;D、G同主族,则G为硫;E、F的原子序数之和是D的原子序数的3倍,D、E、F的简单离子具有相同电子层结构,由8×32=12可知,E为钠,F为铝,
(1)B为碳,D为氧,F为铝,故答案为:碳;氧;铝;
(2)A与D、A与G均可形成18e-的化合物为H2O2、H2S,H2O2具有氧化性,H2S具有还原性,二者发生氧化还原反应为H2O2+H2S=S↓+2H2O,
故答案为:H2O2+H2S=S↓+2H2O;
(3)A、D、E三种元素中的两种或三种形成的物质有Na2O2、Na2O、NaOH等,含有非极性键的离子化合物为Na2O2,其电子式为

,只含离子键的化合物为Na2O,其电子式为

,故答案为:

;

;
(4)E、F的简单离子具有相同电子层结构,原子序数大的离子半径小,则铝离子的半径小,E?和F元素最高价氧化物对应的水化物分别为NaOH、Al(OH)3,发生的离子反应为
Al(OH)3+OH-=AlO2-+2H2O,故答案为:大于;Al(OH)3+OH-=AlO2-+2H2O;
(5)BC-电子数为6+7+1=14,N2的电子数为7×2=14,CO的电子数为6+8=14,C2H2的电子数为6×2+1×2=14,故答案为:N2;CO;C2H2.
本题解析:
本题难度:一般
3、填空题 (10分 )Ⅰ.1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
⑴.科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
晶体
| NaCl
| KCl
| CaO
|
晶格能/(kJ·mol-1)
| 786
| 715
| 3 401
|
4种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是 ??。
⑵.科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.
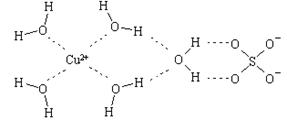
①写出基态Cu原子的核外电子排布式?
②写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来)?
Ⅱ.常见有机化合物,如①CH2=CH2、②CH≡CH、③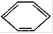 等,其中碳原子采取sp2杂化的分子有?(填物质序号),HCHO分子中心原子C也是采取sp2杂化成键,预测HCHO分子的立体结构为?形。
等,其中碳原子采取sp2杂化的分子有?(填物质序号),HCHO分子中心原子C也是采取sp2杂化成键,预测HCHO分子的立体结构为?形。
参考答案:Ⅰ.MgO>CaO>NaCl>KCl?
①1s22s22p63s23p63d104s1或[Ar] 3d104s1? ② ? Ⅱ.①③?平面三角
? Ⅱ.①③?平面三角
本题解析:Ⅰ.(1)根据数据可知形成离子键的离子半径越小,所带电荷数越多,离子键越强,晶格能越大。镁离子半径小于钙离子半径,所以氧化镁的晶格能大于氧化钙的,熔点由高到低的顺序是MgO>CaO>NaCl>KCl。
(2)①根据构造原理可知基态Cu原子的核外电子排布式1s22s22p63s23p63d104s1或[Ar] 3d104s1。
②胆矾晶体中水合铜离子是通过配位键形成的配合物,其中水是配体,所以结构简式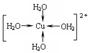 。
。
Ⅱ.碳碳双键是平面型结构,所以是sp2杂化。乙炔是直线型结构,碳原子是sp杂化。HCHO中碳原子和2个氢原子形成单键,和氧原子形成双键,所以是sp2杂化,属于平面三角形结构。
本题难度:一般
4、选择题 下列分子中所有原子都满足最外层为8电子结构的是
[? ]
A.BF3?
B.SiF4
C.H2S
D.PCl5
参考答案:B
本题解析:
本题难度:简单
5、选择题 下列说法中错误的是
[? ]
A.SO2、SO3都是极性分子
B.在NH4+和[Cu(NH3)4]2+中都存在配位键
C.元素电负性越大的原子,吸引电子的能力越强
D.原子晶体中原子以共价键结合,具有键能大,熔点高、硬度大的特性
参考答案:A
本题解析:
本题难度:简单