微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法中正确的是( )?
A.难失电子的原子,获得电子的能力一定强?
B.易得电子的原子所形成的简单阴离子,其还原性一定强?
C.分子中键能越大,键长越长,则分子越稳定?
D.电子层结构相同的不同离子,核电荷数越多半径越小
参考答案:D?
本题解析:A错误,ⅣA的元素最外层有4个电子,既难失电子,也难获得电子;B错误,易得电子的原子所形成的简单阴离子,其还原性弱;C错误,分子中键能越大,键长越短,分子越稳定;D正确,电子层结构相同的不同离子,核电荷数越多,原子对电子的吸引力越强,半径越小。?
本题难度:一般
2、选择题 下列化合物中既含有离子键又含有非极性共价键的化合物是
[? ]
A.CaBr2?
B.NaOH?
C.Na2O2?
D.H2O2
参考答案:C
本题解析:
本题难度:简单
3、简答题 有A、B、C、D四种元素都为短周期元素,A元素形成的-2价阴离子比氦原子的核外电子数多8个,B?元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质,C为原子核内有12个中子的二价金属,当2.4克C与足量热水反应时,在标准状况下放出气体2.24L,D的M层上7个电子.
(1)写出A?B?C?D元素符:A______,B______,C______,D______D在周期表的位置:______.
(2)写出A的原子结构示意图:______.B的离子结构示意图:______
(3)分别写出B、D的最高价氧化物的水化物的化学式______,______.
(4)比较D的气态氢化物与H2S和HF的稳定性:______
(5)用电子式表示B与D形成的化合物的过程:______.
参考答案:短周期元素,A元素形成的-2价阴离子比氦原子的核外电子数多8个,则A的质子数为8,即A为O;B元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质,则B为Na;C为原子核内有12个中子的二价金属,当2.4克C与足量热水反应时,在标准状况下放出气体2.24L,由电子守恒可知,2.4gM×2=2.24L22.4L/mol×2×(1-0),则M为24,其质子数为12,即C为Mg;D的M层上7个电子,则D在第三周期第ⅦA族,则D为Cl;
(1)由上述推断可知,A为O,B为Na,C为Mg,D为Cl,Cl在元素周期表中第3周期第ⅦA族,故答案为:O;Na;Mg;Cl;第3周期第ⅦA族;
(2)O的质子数为8,其原子结构示意图为
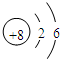
,Na的质子数为11,则离子的结构示意图为

,故答案为:
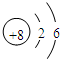
;

;
(3)Na的最高价氧化物的水化物为NaOH,Cl的最高价氧化物的水化物的化学式为HClO4,故答案为:NaOH;HClO4;?
(4)D的气态氢化物为HCl,非金属性F>Cl>S,则气态氢化物的稳定性为HF>HCl>H2S,故答案为:HF>HCl>H2S;
(5)Na的最外层1个电子,Cl的最外层7个电子,则氯化钠的形成过程为
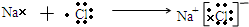
,
故答案为:
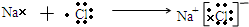
.
本题解析:
本题难度:一般
4、选择题 下列说法中,正确的是
A.BF3分子中没有原子的最外层满足8电子稳定结构
B.在0.1 mol NaHSO4晶体中阳离子与阴离子总数为0.3 NA
C.全氟丙烷(C3F8)分子中三个碳原子可能处于同一直线上
D.向30 mL 0.5 mol/L NaOH(aq)中通入224 mL CO2(标准状况),其离子反应方程式可表示为:3OH-+2CO2=CO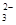 +HCO
+HCO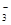 +H2O
+H2O
参考答案:D
本题解析:A:其中F原子满足最外层8电子结构
B:阳离子(Na+)与阴离子(HSO4—)总数为0.2 NA
C:三个碳原子呈锯齿状,不在同一直线上
D:两物质的物质的量比为3:2,正确
答案为D
本题难度:一般
5、选择题 下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
A.NH4Cl
NH3↑+HCl↑
B.CaO+3CCaC2+CO↑
C.2Na2O2+2CO2═2Na2CO3+O2
D.2NaOH+Cl2═NaCl+NaClO+H2O
参考答案:C
本题解析:
本题难度:一般