微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在0.1mol·L一CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO一+H+,对于该平衡,下列叙述不正确的是? (? )
CH3COO一+H+,对于该平衡,下列叙述不正确的是? (? )
A.加入水时,平衡向正反应方向移动,溶液中n(H+)增大
B.加入少量冰醋酸,平衡向正反应方向移动,溶液中c(H+)增大
C.加入少量0.1 mol·L-HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向逆反应方向移动,溶液中c(H+)减小
参考答案:C
本题解析:A加入水时,促进弱酸的电离,平衡向正反应方向移动,溶液中n(H+)增大,正确;B、加入少量冰醋酸,增大反应物浓度,平衡向正反应方向移动,溶液中c(H+)增大,正确;C、加入少量0.1 mol·L-HCl溶液,H+浓度增大,不正确;D、加入少量CH3COONa固体,CH3COO?浓度增大,平衡向逆反应方向移动,溶液中c(H+)减小,正确。
本题难度:一般
2、选择题 在0.1mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH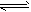 CH3COO-+H+,下列叙述正确的是
CH3COO-+H+,下列叙述正确的是
[? ]
A.加入水时,平衡向逆反应方向移动
B.加入少量CH3COONa固体,平衡向正反应方向移动
C.加入少量0.1mol·L-1HCl溶液,平衡向逆反应方向移动,溶液中c(H+)增大
D.加入少量NaOH固体,平衡向正反应方向移动
参考答案:CD
本题解析:
本题难度:一般
3、选择题 25℃时,在某物质的溶液中,由水电离出的c(H+)=1×10-amol/L,下列说法不正确的是( )
A.a<7时,水的电离受到抑制
B.a>7时,水的电离受到抑制
C.a<7时,溶液的pH一定为a
D.a>7时,溶液的pH一定为14-a
参考答案:A.如果a<7,则促进水电离,故A错误;
B.如果a>7,则抑制水电离,故B正确;
C.如果a<7,则促进水电离,该溶液为盐溶液,溶液的pH=a,故C正确;
D.如果a>7,则抑制水电离,该溶液为酸溶液或碱溶液,则该溶液的PH值为a或14-a,故D错误;
故选AD.
本题解析:
本题难度:一般
4、填空题 亚磷酸(H3PO3)是二元酸,与足量NaOH溶液反应生成Na2HPO3。
(1)PCl3水解可制取亚磷酸:PCl3+3H2O===H3PO3+________。
(2)H3PO3溶液中存在电离平衡:H3PO3 H++H2PO3—。
H++H2PO3—。
①某温度下,0.10 mol·L-1的H3PO3溶液pH=1.6,即溶液中c(H+)=2.5×
10-2 mol·L-1。求该温度下上述电离平衡的平衡常数K,写出计算过程。(H3PO3的第二步电离忽略不计,结果保留两位有效数字)
②根据H3PO3的性质可推测Na2HPO3稀溶液的pH________7(填“>”“=”或“<”)。
(3)亚磷酸具有强还原性,可使碘水褪色。该反应的化学方程式为________。
(4)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:
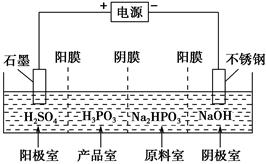
①阴极的电极反应式为________________________;
②产品室中反应的离子方程式为_____________________。
参考答案:(1)3HCl
(2)① H3PO3 ? ?H+ + H2PO3—
?H+ + H2PO3—
起始时浓度
(mol·L-1) ? 0.10 0 0
反应的浓度
(mol·L-1) ? 2.5×10-2 2.5×10-2 2.5×10-2
平衡时浓度
(mol·L-1)? 0.10-2.5×10-2 ?2.5×10-2 2.5×10-2
K=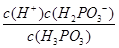 =8.3×10-3 ②>
=8.3×10-3 ②>
(3)H3PO3+I2+H2O===2HI+H3PO4
(4)①2H2O+2e-===H2↑+2OH-
②HPO32—+2H+===H3PO3
或HPO32—+H+===H2PO3—、H2PO3—+H+===H3PO3
本题解析:(1)由质量守恒可知另一产物是HCl。(2)Na2HPO3水解使溶液呈碱性。(3)由于+3价P被氧化只能生成+5价P,故产物是HI和H3PO4。(4)在电解槽中通过选择性膜进入产品室的微粒为H+和HPO32—。
本题难度:一般
5、填空题 (14分)回答下列问题:
(1)下列物质中 ①Cu ②液态SO2 ③CH3COOH ④NaHCO3 ⑤Ba(OH)2溶液 ⑥熔融NaCl ⑦稀氨水 ⑧BaSO4 ⑨H2O。属于强电解质的是 (填序号),属于弱电解质的是 (填序号);写出③的电离方程式
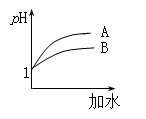
(2)25 ℃时,向pH均为1的盐酸和醋酸溶液中分别加水,随加水量的增多,两溶液pH的变化如图所示,则符合盐酸pH变化的曲线是 ;
(3)一定温度下,有a.盐酸、b.硫酸、c.醋酸三种酸(用a、b、c来回答)。当它们的pH相同、体积相同时,分别加入足量锌,相同状况下产生的气体体积由大到小的顺序为________;当它们的物质的量浓度相同时,pH由大到小的顺序是_____________。
(4)现有25℃、pH=13的Ba(OH)2溶液,与某浓度盐酸溶液按体积比(碱与酸之比)1:9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH= .
参考答案:(1)④⑥⑧ ③⑨ CH3COOH 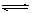 CH3COO-+H+ (2)A (3)c>a=b; c >a> b (4)2
CH3COO-+H+ (2)A (3)c>a=b; c >a> b (4)2
本题解析:
试题解析:(1)能够完全电离的为强电解质,满足条件为:④NaHCO3 ⑥熔融NaCl ⑧BaSO4 ;只能部分电离,存在电离平衡的为弱电解质,满足条件为:③CH3COOH ⑨H2O; 醋酸在水溶液中电离出醋酸根和氢离子,电离方程式为:CH3COOH 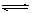 CH3COO-+H+;(2)pH相等的醋酸和盐酸中,加水稀释促进醋酸电离,导致稀释相同的倍数时,醋酸的pH大于HCl,根据图象知,A是HCl变化曲线,故选A;(3)当c(H+)相同、体积相同时,盐酸、硫酸完全电离,只有醋酸在继续电离,则分别加入足量锌,相同状况产生的气体体积由大到小的顺序为c>a=b,
CH3COO-+H+;(2)pH相等的醋酸和盐酸中,加水稀释促进醋酸电离,导致稀释相同的倍数时,醋酸的pH大于HCl,根据图象知,A是HCl变化曲线,故选A;(3)当c(H+)相同、体积相同时,盐酸、硫酸完全电离,只有醋酸在继续电离,则分别加入足量锌,相同状况产生的气体体积由大到小的顺序为c>a=b,
故答案为:c>a=b;硫酸为二元强酸,盐酸为一元强酸,醋酸为一元弱酸,则物质的量浓度相同时,c(H+)由大到小的顺序是b>a>c;(2)设盐酸的物质的量浓度为:C(HCl),碱与酸体积分别为1L、9L,则n(OH -)=0.1mol/L×1L=0.1mol,n(H+)=C(HCl)×9L,反应后剩余氢氧根离子的物质的量为:0.1mol-c(HCl)×9L;有混合所得溶液pH=11,可知混合后c(H+)=10-11 mol?L-1,则混合后c(OH -)= =10-3 mol?L-1,即:
=10-3 mol?L-1,即: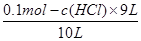 =10-3 mol?L-1,解得:c(HCl)=10-2mol?L-1,pH=-lg[H+],所以pH=2.
=10-3 mol?L-1,解得:c(HCl)=10-2mol?L-1,pH=-lg[H+],所以pH=2.
考点:弱电解质的电离;pH的简单计算
本题难度:一般