| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《化学平衡》考点特训(2017年冲刺版)(六)
(2)由表中数据分析可知,Q______0(填“>”、“<”或“=”).其它条件不变的情况下,若压缩容器的体积,则平衡______移动(“向正反应方向”“向逆反应方向”或“不”),化学平衡常数K______(填“增大”、“减小”或“不变”). (3)在体积一定的密闭容器中,能说明该反应已处于化学平衡状态的是______(填编号). a.V正(CO)=1/2V正(H2)b.混合气体的密度保持不变 c.反应体系中的热效应不再变化d.c(CO):c(CH3OH)=1:1 (4)寻找到合适的催化剂是实现反应工业化的关键.该反应使用催化剂无法实现的目标是______(填编号). a.提高单位时间内甲醇的产量b.增大混合气体中甲醇的体积分数 c.缩短达到平衡所需时间d.提高一氧化碳的转化率. 参考答案:(1)依据化学平衡三段式列式得到 本题解析: 本题难度:一般 2、简答题 已知2NO2(g)?N2O4(g)△H(298K)=-52.7kJ?mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验: 参考答案:(1)浓硫酸稀释时放出热量,导致溶液的温度升高,硝酸铵溶解时吸收热量,导致溶液的温度降低,反应2NO2(g)?N2O4(g)是放热反应,A烧杯中,升高温度,平衡向逆反应方向移动,二氧化氮气体浓度增大,气体颜色加深,降低温度,平衡向正反应方向移动,二氧化氮浓度降低,所以气体颜色变浅,故答案为:气体颜色加深,气体颜色变浅; 本题解析: 本题难度:一般 3、选择题 已知N2(g)+3H2(g) |
参考答案:B
本题解析:
A.在合成NH3的可逆反应中,加压有利于平衡正移。
B.温度低虽然有利于两个平衡正移,提高转化率,但是温度低,速率太慢,生产效率低下。
C.制取SO2中,SO2价格贵,O2适当过量,SO2转化率大,经济性好
D.及时分离从合成塔中混合气体中的氨气,有利于合成氨
考点:1、影响化学反应速率的因素 2、影响化学平衡的因素
本题难度:一般
4、选择题 4、在体积固定不变的密闭容器中,充入2molNO和1molO2,在一定条件下达到平衡时,NO的转化率为95%,此时容器内的压强与开始时的压强之比是:
A.等于2.05/3
B.小于2.05/3
C.大于2.05/3
D.等于2/3
参考答案:B
本题解析: 2NO + O2 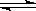 2NO2
2NO2
始 2mol 1mol 0
转 1.9mol 0.95mol 1.9mol
平 0.1mol 0.05mol 1.9mol
压强比= =
= =
=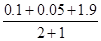 =
=
但由于该反应为可逆反应,所以小于2.05/3
考点:转化率的计算
点评:本题要弄清楚什么是可逆反应,以及简单的计算,要掌握可逆反应的特点。
本题难度:一般
5、填空题 甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1?mol?CH4和2?mol?H2O(g)通入反应室(容积为100L),并在一定条件下发生如下反应:CH4(g)+H2O(g)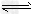 CO(g)+3H2(g)……Ⅰ 测得CH4的转化率与温度、压强的关系如图。
CO(g)+3H2(g)……Ⅰ 测得CH4的转化率与温度、压强的关系如图。 
①当压强为P1,温度为100℃时达到平衡所需的时间为5min。则用H2表示0~5min内的平均反应速率为_? 。
②图中的P1_?_P2(填“<”、“>”或“=”)。
③100℃时该反应的平衡常数为_?_。
④在其它条件不变时降低温度,反应I的逆反应速率将_?_(填“增大” “减小”或“不变”),反应?移动(填“向正方向”、“向逆方向”或“不”)。
(2)在压强为0.1 MPa条件下, 将a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇,其反应如下:CO(g)+2H2(g) CH3OH(g)……II
CH3OH(g)……II
①则该反应的△H_?_0,△S_? _0(填“<”、“>”或“=”)。
②若容器容积不变,下列措施可增加甲醇产率的是_?_。
A.升高温度?
B.将CH3OH(g)从体系中分离出来
C.充入He,使体系总压强增大?
D.再充入1mol CO和3mol H2
③为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计的表中。请在下表空格中填入剩余的实验条件数据。
参考答案:(1)①0.003mol·L-1·min-1;②<;③2.25 ×10-4;④减少;向逆反应方向
(2)①<;<;②BD③
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《三氧化硫》.. | |