微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定条件下KI、Zn、FeBr2分别与足量的Cl2反应,如果3个反应得失电子数目相等,则KI、Zn、FeBr2的物质的量之比为( )
A.1:2:3
B.3:2:1
C.6:3:2
D.2:3:6
参考答案:反应中只有氯气是氧化剂,3个反应得失电子数目相等,则3个反应中参加反应的氯气的物质的量相等,
令参加反应的氯气为1mol,则:
2KI+Cl2═2KCl+I2
2 1
n(KI) 1mol
故n(KI)=2mol
Zn+Cl2═ZnCl2
11
n(Zn) 1mol
则n(Zn)=1mol
2FeBr2+3Cl2═2FeCl3+2Br2
2 3
n(FeBr2) 1mol
则n(FeBr2)=1mol×23=23mol
故n(KI):n(Zn):n(FeBr2)=2mol:1mol:23mol=6:3:2
故选C.
本题解析:
本题难度:一般
2、选择题 下列是爱迪生电池分别在充电和放电时发生的反应:Fe+ NiO2+2H2O Fe(OH)2+Ni(OH)2,消耗0.54g H2O时,电解0.01molCuSO4和0.01molNaCl混合溶液100mL,两极产生气体标况下总体积是?
Fe(OH)2+Ni(OH)2,消耗0.54g H2O时,电解0.01molCuSO4和0.01molNaCl混合溶液100mL,两极产生气体标况下总体积是?
[? ]
A、0.168L
B、0.224L
C、0.336L
D、0.672L
参考答案:C
本题解析:
本题难度:一般
3、填空题 (1)已知Fe3+的氧化性大于Cu2+,根据此性质,某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路。用离子方程式表示其化学原理__________________
某实验小组对该厂生产印刷电路后所得的废液进行了分析: 取50.00 mL废液,向其中加入0.64 g金属铜,金属铜全部溶解;另取50. 00 mL废液,向其中加入足量的AgNO3溶液,析出沉淀43. 05 g。请回答以下问题:
(2)该厂产生的废液中所含金属离子有____ ;该厂原来使用的FeCl3溶液的物质的量浓度____ (反应前后溶液的体积变化忽略不计)。
参考答案:(1)2Fe3+ +Cu=2Fe2+ +Cu2+
(2)Fe3+、Fe2+、Cu2+ ;2.00 mol/L
本题解析:
本题难度:一般
4、简答题 已知H2S和?SO2?反应生成?S和?H2O
①写出反应的化学方程式并标出电子转移的方向和数目______
②上述反应中被氧化的硫原子和被还原的硫原子的物质的量之比为______
③现有H2S和?SO2混合气体1mol,充分反应后得到的产物中,若还原产物比氧化产物少1.6g,则反应中转移电子数为______NA,原混合物中H2S和?SO2的物质的量可能各是多少______.
参考答案:①H2S+SO2→S+2H2O的反应中,硫化氢中硫元素失电子由-2价→0价,二氧化硫中硫元素由+4价→0价,所以得失电子的最小公倍数是4,则硫化氢的计量数是2,二氧化硫的计量数是1,然后根据原子守恒配平方程式得2H2S+SO2=3S+2H2O,该反应的化学方程式及电子转移的方向和数目为:
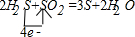
,
故答案为:
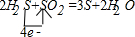
;
②该反应中硫化氢是还原剂,二氧化硫是氧化剂,且硫化氢和二氧化硫分子中都含有一个硫原子,根据方程式知,被氧化的硫原子和被还原的硫原子的物质的量之比为2:1,故答案为:2:1;
③设转移电子数为x,
2H2S+SO2=3S+2H2O 转移电子? 氧化产物和还原产物的差
? 4NA?32g
? x?1.6g
x=1.6g×4NA32g=0.2NA,
假设硫化氢完全反应,则硫化氢的物质的量为y,
2H2S+SO2=3S+2H2O? 氧化产物和还原产物的差
2mol? 32g
y? 1.6g
y=2mol×1.6g32g=0.1mol,则二氧化硫的物质的量=(1-0.1)mol=0.9mol;
假设二氧化硫完全反应,则二氧化硫的物质的量为z,
2H2S+SO2=3S+2H2O? 氧化产物和还原产物的差
? 1mol? 32g
? z? 1.6g
z=1mol×1.6g32g=0.05mol,则硫化氢的物质的量=(1-0.05)mol=0.95mol,
故答案为:0.2;
本题解析:
本题难度:一般
5、选择题 24 mL浓度为0.05 mol/L的Na2SO3溶液恰好与20 mL 浓度为0.02mol/L的K2Cr2O7溶液完全反应。已知Na2SO3被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为
[? ]
A.+2
B.+3
C.+4
D.+5
参考答案:B
本题解析:
本题难度:一般