微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 氮及其化合物在工农业生产中具有重要作用。
(1)某小组进行工业合成氨N2(g)+3H2(g) 2NH3(g)?△H<0的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。
2NH3(g)?△H<0的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。
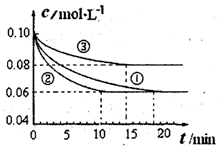
实验②从开始到达到平衡状态的过程中,用H2表示的平均反应速率为?。与实验①相比,.实验②所采用的实验条件可能为?(填字母),实验③所采用的实验条件可能为?(填字母)。
a.增大压强b.减小压强c.升高温度d.降低温度e.使用催化剂
(2)NH3可用于处理废气中的氮氧化物,其反应原理为2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g)?△H<0欲提高废气中氮氧化物的转化率,可采取的措施是?(填字母)
2N2(g)+3H2O(g)?△H<0欲提高废气中氮氧化物的转化率,可采取的措施是?(填字母)
a.升高温度? b.增大压强? c,增大NH3的浓度
(3)NCl3遇水发生水解反应,生成NH3的同时得到?(填化学式)。ClO2是广谱高效消毒剂,制备原理为NCl3+6ClO2-+3H2O=NH3↑+6ClO2+3OH-+3Cl-。若转移1mol电子,则制取ClO2的质量为?。
(4)25℃时,将amol·L-1的氨水与bmol·L-1盐酸等体积混合,反应后溶液恰好显中性,则a?b(填“>”、“<”或“=”)。用a、b表示NH3·H2O的电离平衡常数为?。
参考答案:(12分)(1)0.012mol/(L?min)(2分) e(1分) c(1分) (2)c(2分)
(3)HClO(1分) 67.5(2分) (4)>(1分) 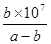 mol/L(2分)
mol/L(2分)
本题解析:(1)根据图像可知,实验②中反应进行到10min到达平衡状态,平衡时氮气的物质的量浓度减少了=0.1mol/L-0.06mol/L=0.04mol/L。根据方程式可知,氢气的浓度变化量△c(H2)=3△c(N2)=3×0.04mol/L=0.12mol/L,所以υ(H2)=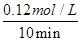 =0.012mol/(L?min);根据图像可知,与实验①相比,实验②到达平衡所用时间比较短,反应速率较快,但平衡时氮气的浓度不变,即改变条件平衡不移动。由于该反应正反应是气体体积减小的反应,故实验②的条件应是使用了催化剂,答案选e;根据图像可知,与实验①相比,实验③到达平衡所用时间也比较短,反应速率较快,但平衡时氮气的浓度增大,这说明改变体积平衡向逆反应移动。由于该反应正反应是体积减小的放热反应,因此实验③所采用的实验条件是升高温度,答案选c。
=0.012mol/(L?min);根据图像可知,与实验①相比,实验②到达平衡所用时间比较短,反应速率较快,但平衡时氮气的浓度不变,即改变条件平衡不移动。由于该反应正反应是气体体积减小的反应,故实验②的条件应是使用了催化剂,答案选e;根据图像可知,与实验①相比,实验③到达平衡所用时间也比较短,反应速率较快,但平衡时氮气的浓度增大,这说明改变体积平衡向逆反应移动。由于该反应正反应是体积减小的放热反应,因此实验③所采用的实验条件是升高温度,答案选c。
(2)提高废气中氮氧化物的转化率,应改变条件使平衡向正反应移动,则:
a.该反应正反应是放热反应,升高温度,平衡向逆反应移动,氮氧化物的转化率降低,故a错误;
b.该反应正反应是体积增大的反应,增大压强,平衡向逆反应移动,氮氧化物的转化率降低,故b错误;c.增大NH3的浓度,平衡向正反应移动,氮氧化物的转化率增大,故c正确,答案选c。
(3)NCl3遇水发生水解反应生成NH3,这说明NCl3分子中负价原子结合水电离的H+,因此正价原子结合水电离的OH-,所以生成NH3的同时还得到HClO;反应中只有氯元素的化合价发生变化,氯元 素由NCl3中+1降低为Cl-中-1价,得到电子;由ClO2-中+3价升高为ClO2中+4价,失去1个电子,即每生成1molClO2,反应中就转移1mol电子。所以当转移1mol电子时,生成ClO2的物质的量为1mol,质量为1mol×67.5g/mol=67.5g。
(4)溶液显中性,所以c(H+)=c(OH-)。根据溶液的电荷守恒可得:c(H+)+c(NH4+)=c(Cl-)+ c(OH-),因此c(NH4+)=c(Cl-)。氯化铵是强酸弱碱盐,NH4+水解,其水溶液呈酸性,因此要使氯化铵溶液呈中性,则氨水应稍微过量。因为盐酸和氨水的体积相等,则氨水的物质的量浓度大于盐酸,即a>b;溶液中c(H+)=c(OH-)=10-7mol/L,c(NH4+)=c(Cl-)=0.5bmol/L,所以c(NH3?H2O)=0.5amol/L-0.5bmol/L。电离常数只与温度有关,则此时NH3?H2O的电离常数Kb=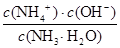 =
=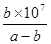 mol/L.。
mol/L.。
本题难度:一般
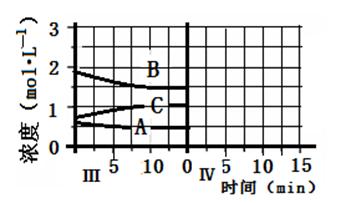
2、填空题 反应aA(g)+bB(g) cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:

回答问题:
(1)反应的化学方程式中,a:b:c为??;
(2)B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最大的是??,其值是??;
(3)由第一次平衡到第二次平衡,平衡移动的方向是?,采取的措施是??;
(4)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2?T3?(填“<”、“>或“=”),判断的理由是??;
(5)达到第三次平衡后,将容器的体积扩大一倍,假定10min后达到新的平衡,请在下图中用曲线表示第IV阶段体系中B物质的浓度随时间变化的趋势(注:只须画出B的浓度随时间变化曲线)。
参考答案:(1)1∶3∶2(2分)
(2)αⅠ(B)(2分)? 50%(2分)
(3)向正反应方向(2分)?从反应体系中移出产物C(2分)
(4)>(2分)?此反应为放热反应,降低温度,平衡向正反应方向移动(或降低温度,反应速率减慢)(2分)
(5)(2分)
本题解析:(1)由图可知第Ⅰ阶段,平衡时△c(A)=2mol·L-1-1mol·L-1=1mol·L-1,△c(B)=6mol·L-1-3mol·L-1=3mol·L-1,△c(C)=2mol·L-1,浓度变化量之比等于化学计量数之比,故a:b:c=1mol·L-1:3mol·L-1:2mol·L-1=1:3:2,答案为:1:3:2;
⑵B的平衡转化率αⅠ(B)= ×100%=50%,αⅡ(B)=
×100%=50%,αⅡ(B)=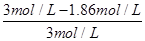 ×100%=38%,αⅢ(B)=
×100%=38%,αⅢ(B)=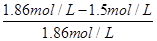 ×100%=19.4%,答案为:αⅠ(B);50%;
×100%=19.4%,答案为:αⅠ(B);50%;
⑶第Ⅱ阶段C是从0开始的,瞬间A、B浓度不变,因此可以确定第一次平衡后从体系中移出了C,即减少生成物浓度,平衡正向移动,答案为:平衡正向移动;从反应体系中移出产物C;
⑷第Ⅲ阶段的开始与第Ⅱ阶段的平衡各物质的量均相等,根据A、B的量减少,C的量增加可判断平衡是正向移动的,根据平衡开始时浓度确定此平衡移动不可能是由浓度的变化引起的,另外题目所给条件容器的体积不变,则改变压强也不可能,因此一定为温度的影响,此反应正向为放热反应,可以推测为降低温度,另外结合A的速率在三个阶段的情况,确定改变的条件一定为降低温度,根据勒夏特列原理,平衡的移动只能减弱改变,不能抵消改变,因此达到平衡后温度一定比第Ⅱ阶段平衡时的温度低,答案为:>;此反应为放热反应,降低温度,平衡向正反应方向移动。
⑸将容器的体积扩大一倍后,容器内压强减小,平衡向逆反应方向移动,A和B的物质的量增大,C的物质的量减小,但容器体积增大,则A、B、C的浓度都减小,

本题难度:一般
3、填空题 (14分)二甲醚(CH3OCH。)和甲醇(CH3OH)被称为21世纪的新型燃料,具有清洁、高效等优良的性能。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
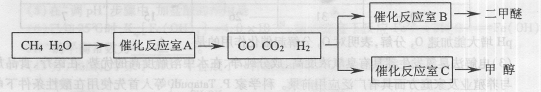
(1)催化反应室B中CO 与H2合成二甲醚的化学方程式为?.
与H2合成二甲醚的化学方程式为?.
(2)催化反应室A中发生的反应为:
CH4(g)+H2O(g) CO(g)+3H2(g)……(I)、CO(g)+H2O(g)
CO(g)+3H2(g)……(I)、CO(g)+H2O(g) CO2(g)+H2(g)……(Ⅱ)催化反应室C中发生的反应为:
CO2(g)+H2(g)……(Ⅱ)催化反应室C中发生的反应为:
CO(g)+2H2(g) CH3OH(g)……(Ⅲ)、CO2(g)+3H2(g)
CH3OH(g)……(Ⅲ)、CO2(g)+3H2(g) CH3OH(g)+H2O(g)……(Ⅳ)
CH3OH(g)+H2O(g)……(Ⅳ)
①已知:原子利用率= ×100%,试求反应(Ⅳ)的原子利用率为?。
×100%,试求反应(Ⅳ)的原子利用率为?。
②反应(Ⅳ)的△S ?0(填“>”、“=”或“<”)。
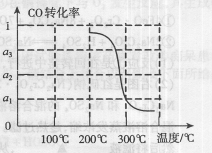
③在压强为5MPa,体积为VL的反应室c中,amol CO与20mol H2在催化剂作用下发生反应(Ⅲ)生成甲醇,CO的转化率与温度的关系如右图。则该反应的△H?0(填“>”、“=”或“<”)。300℃时该反应的平衡常数K= ?(用含字母的代数式表示)。
(3)我国某科研所提供一种碱性“直接二甲醚燃料电池”。
该燃料电池负极的电极反应式为:
CH3OCH3一12e一+16OH一=2CO2-3+11H2O。有人提出了一种利用氯碱工业产品治理含二氧化硫(体积分数为x)废气的方法如下:
①将含SO2的废气通人电解饱和食盐水所得溶液中,得NaHSO3溶液;
②将电解饱和食盐水所得气体反应后制得盐酸;
③将盐酸加入NaHSO3溶液中得SO2气体回 收。
收。
用上述碱性“直接二甲醚燃料电池”电解食盐水来处理标准状况下VL的废气,计算消耗二甲醚的质量。
参考答案:

本题解析:略
本题难度:简单
4、填空题 向一容积为5 L的密闭容器中充入NH3和O2,它们的物质的量之比为1∶2,发生如下反应:4NH3+5O2 4NO+6H2O(g)。
4NO+6H2O(g)。
(1)上述反应在一定条件下进行,2 min后该反应的ΔH-TΔS=0,此时该反应达到__________________状态,NH3为2 mol,NH3的转化率为20%。以NO的浓度变化表示该反应的平均反应速率为________________, O2的平衡浓度为_________________。
(2)在达到平衡后,充入相当于原组成气体1倍的惰性气体。如果容器的体积不变,平衡______________移动。
参考答案:(1)平衡 0.05 mol·(L·min)-1 0.875 mol·L-1(2)不
本题解析:(1)当ΔH-TΔS<0时反应能自发进行;ΔH-TΔS=0,反应处于平衡状态;ΔH-TΔS>0,反应不能自发进行。设起始NH3物质的量为x,则生成NO的物质的量即变化的NH3的物质的量为(x-2) mol,(x-2)÷x=20%,x="2.5" mol,所以,以NO的浓度变化表示该反应的平均反应速率为(2.5 mol-2 mol)÷5 L÷2 min="0.05" mol·(L·min)-1;起始O2的物质的量为5 mol,消耗的O2为:0.5 mol×5/4="0.625" mol,O2的平衡浓度为:(5 mol-0.625 mol)÷5 L="0.875" mol·L-1。(2)达到平衡后,充入相当于原组成气体1倍的惰性气体,混合物中各组分浓度不变,正逆反应速率不变,平衡不发生移动。
本题难度:简单
5、选择题 一定条件下,可逆反应2A(g)+B(s)
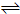
2C(g)一定达平衡的是( )
A.恒温恒容时,压强不再变化时
B.恒温恒压时,体积不再变化
C.恒温恒容时,气体密度不再变化
D.A、B、C的物质的量之比为2:1:2
参考答案:A.反应前后气体的化学计量数之和相等,无论是否达到平衡状态,容器压强都不发生变化,故A错误;
B.由于反应前后气体的物质的量不变,恒温恒压时,气体的体积不变,不能作为判断是否达到化学平衡的依据,故B错误;
C.反应中B为固体,反应达到平衡时,气体的总质量不变,则密度不变,可作为达到平衡状态的依据,故C正确;
D.反应平衡时各物质的物质的量之比取决于起始物质的量以及反应转化的程度,不能作为判断是否达到化学平衡的依据,故D错误.
故选C.
本题解析:
本题难度:简单