| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《物质的组成》高频试题强化练习(2017年最新版)(六)
(5)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为?(用对应的元素符号表示)。 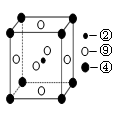 参考答案:(1)⑨?(1分) 本题解析:(1)区的名称来自按照构造原理最后通入电子轨道的能级名称,所以属于d区的是⑨,即镍元素。 本题难度:一般 4、填空题 (每空2分?共8分)研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题。
(4) 利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。COCl2分子的结构式为 Cl—eq o(sup 10(O║—Cl,则COCl2分子内含有________。 A.4个σ键? B.2个σ键、2个π键 C.2个σ键、1个π键? D.3个σ键、1个π键 参考答案:(每空2分,共8分)? (1) N>C>Si? (2) 1s22s22p63s2?(3) 有? (4) D 本题解析:(1)非金属性越强,电负性越大。C、Si、N元素元素的非金属性强弱顺序是N、C、Si,所以其电负性由大到小的顺序是 N>C>Si。 本题难度:一般 5、选择题 下列说法正确的是 ?( ) 参考答案:B 本题解析:A项:最外层电子数不同,化学性质也不同,故错;C项:最外层应是8个电子,故错;D项:2s先排2个,再排2p,故错。故选B。 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《物质的性质.. | |