微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 可逆反应2NO2(g)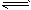 2NO(g) + O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是
2NO(g) + O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是
[? ]
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2的同时生成2n molNO
③NO2、NO、O2的物质的量浓度比值为2∶2∶1
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的总压强不再改变的状态
A.①④⑥
B.②③⑤
C.①③④
D.全部
参考答案:A
本题解析:
本题难度:一般
2、选择题 据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实。2CO2(g)+6H2(g)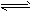 CH3CH2OH(g)+3H2O(g) 下列叙述错误的是
CH3CH2OH(g)+3H2O(g) 下列叙述错误的是
[? ]
A.反应需在300℃进行可推测该反应是吸热反应
B.使用Cu-Zn-Fe催化剂可大大提高生产效率
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
参考答案:A
本题解析:
本题难度:一般
3、填空题 (14分) 2013年10月9日,2013年诺贝尔化学奖在瑞典揭晓,犹太裔美国理论化学家马丁·卡普拉斯、美国斯坦福大学生物物理学家迈克尔·莱维特和南加州大学化学家亚利耶·瓦谢尔因给复杂化学体系设计了多尺度模型而分享奖项。三位科学家的研究成果已经应用于废气净化及植物的光合作用的研究中,并可用于优化汽车催化剂、药物和太阳能电池的设计。
汽车尾气净化的主要原理为:2NO(g) + 2CO(g)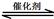 2CO2(g)+ N2(g) △H<0
2CO2(g)+ N2(g) △H<0
(1)同一条件下该反应正反应的平衡常数为K1,逆反应的表达式平衡常数为K2,K1与K2的关系式 。
(2)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
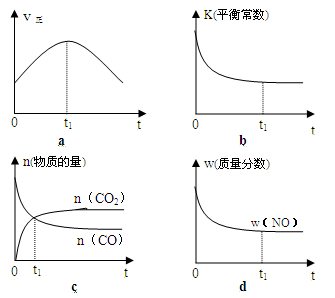
(3)在体积为10L的密闭容器中,加入一定量的CO2和H2,在900℃时发生吸热反应并记录前5min各物质的浓度,第6min改变了条件。各物质的浓度变化如下表;
时间/min
| CO2(mol/L)
| H2(mol/L)
| CO(mol/L)
| H2O(mol/L)
|
0
| 0.2000
| 0.3000
| 0
| 0
|
2
| 0.1740
| 0.2740
| 0.0260
| 0.0260
|
5
| 0.0727
| 0.1727
| 0.1273
| 0.1273
|
6
| 0.0350
| 0.1350
| 0.1650
|
|
①前2min,用CO表示的该化学反应的速率为 ;
②第5—6min,平衡移动的可能原因是 ;
(4)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
2NO2(g) N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol
H2O(g) = H2O(l) △H=-44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
(5)在一定条件下,可以用NH3处理NOx。已知NO与NH3发生反应生成N2和H2O,现有NO和NH3的混合物1mol,充分反应后得到的还原产物比氧化产物多1.4 g,则原反应混合物中NO的物质的量可能是_____________。
(6)在一定条件下,也可以用H2可以处理CO合成甲醇和二甲醚(CH3OCH3)及许多烃类物质。当两者以物质的量1:1催化反应,其原子利用率达100%,合成的物质可能是 。
a.汽油 b.甲醇 c.甲醛 d.乙酸
参考答案:(1)K1=K2-1
(2)bd
(3)①0.0130mol/(L·min) ②升高温度或减小H2O的浓度
(4)CH4(g)+N2O4(g) ==N2(g) +2H2O(g) + CO2(g) △H= —898.1kJ/mol
(5)0.3mol或0.8mol
(6)c
本题解析:(1)2NO(g) + 2CO(g)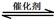 2CO2(g)+ N2(g) △H<0,K1=
2CO2(g)+ N2(g) △H<0,K1= ,逆反应的平衡常数K2=
,逆反应的平衡常数K2=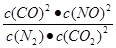 =
=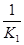 ,所以K1=K2-1;
,所以K1=K2-1;
(2)若该反应在绝热、恒容的密闭体系中进行,反应达到平衡状态时,浓度、转化率等均不随时间的变化而变化,故,本小题选择bd;
(3)① ;
;
②第5—6min,平衡移动的原因是升高温度或减小H2O的浓度;
(4)CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol ①
2NO2(g) N2O4(g) △H=-56.9 kJ/mol ②
N2O4(g) △H=-56.9 kJ/mol ②
H2O(g) = H2O(l) △H = -44.0 kJ/mol ③
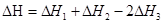 =-898kJ/mol
=-898kJ/mol
热化学方程式为CH4(g)+N2O4(g) ==N2(g) +2H2O(g) + CO2(g) △H= —898.1kJ/mol
(5)NO与NH3发生反应生成N2和H2O,反应方程式为6NO+4NH3=5N2+6H2O,充分反应后得到的还原产物比氧化产物多1.4 g,那么还原产物比氧化产物多 =0.05mol,分为两种情况:①若NO完全反应,n(NO)=
=0.05mol,分为两种情况:①若NO完全反应,n(NO)=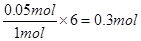 ;②若NH3完全反应,n(NO)=
;②若NH3完全反应,n(NO)=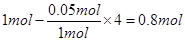 ;
;
(6)当两者以物质的量1:1催化反应,其原子利用率达100%,根据原子守恒,可知产物为甲醛,故选择C。
考点:平衡常数的计算,平衡状态的判断,反应速率的计算,热化学方程式的书写,化学反应的相关计算
本题难度:困难
4、选择题 已知热化学方程式:SO2(g)+ 1/2O2(g) 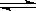 SO3(g) △H =
SO3(g) △H =
参考答案:
本题解析:
本题难度:简单
5、填空题 工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。
(1)某温度下,SO2(g)+1/2O2(g)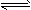 SO3(g)△H=-98 kJ/mol。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出196kJ的热量,该温度下的平衡常数K=_________。
SO3(g)△H=-98 kJ/mol。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出196kJ的热量,该温度下的平衡常数K=_________。
(2)一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1 mol O2,发生下列反应:2SO2(g)+O2(g)
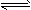 2SO3(g),达到平衡后,改变下述条件,SO2、O2、SO3的平衡浓度都比原来增大的是_______(填字母)。
2SO3(g),达到平衡后,改变下述条件,SO2、O2、SO3的平衡浓度都比原来增大的是_______(填字母)。
A.保持温度和容器体积不变,充入2 mol SO3
B.保持温度和容器体积不变,充入2 mol N2
C.保持温度和容器体积不变,充入0.5 mol SO2和0.25 mol O2
D.保持温度和容器内压强不变,充入1 mol SO3
E.升高温度
F.移动活塞压缩气体
(3)某人设想以下图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:____________
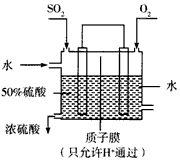
(4)常温时,BaSO4的Ksp=1.08×10-10,现将等体积的BaCl2溶液与2.0×10-3mol/L的Na2SO4溶液混合。若要 生成BaSO4沉淀,BaCl2溶液的最小浓度为___________。
(5)下列关于2SO2(g)+O2(g) 2SO3(g)反应的图像中,正确的是______________。
2SO3(g)反应的图像中,正确的是______________。
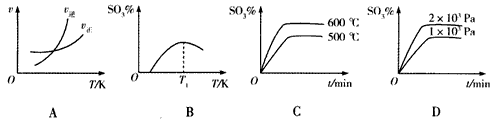
(6)SO2既有氧化性又有还原性,还有漂白性。将SO2通入酸性KMnO4溶液中,酸性KMnO4溶液褪色,SO2表现______性,其中氧化剂和还原剂的物质的量之比为_______(已知:KMnO4的还原产物为Mn2+)。
参考答案:(1)10/3或3.33
(2)ACF
(3)SO2+2H2O-2e-=SO42-+4H+
(4)2. 16×10-7mol/L
(5)ABD
(6)还原;2:5
本题解析:
本题难度:一般