微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)苯乙烯是重要的基础有机化工原料。工业中以乙苯(C6H5-CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5-CH= CH2)的反应方程式为:
C6H5-CH2CH3 (g) C6H5-CH=CH2 (g) +H2(g) ΔH1=+125kJ?mol
C6H5-CH=CH2 (g) +H2(g) ΔH1=+125kJ?mol
参考答案:
本题解析:
本题难度:困难
2、选择题 一定条件下,二氧化氮和四氧化二氮之间存在平衡:2NO2(g)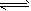 N2O4(g) △H<0 在测定NO2的相对分子质量时,下列条件中测定结果误差最小的是
N2O4(g) △H<0 在测定NO2的相对分子质量时,下列条件中测定结果误差最小的是
[? ]
A.130℃ 3.03×105 Pa
B.25℃ 1.01×105 Pa
C.130℃ 5.05×104 Pa
D.0℃ 5.05×104 Pa
参考答案:C
本题解析:
本题难度:一般
3、填空题 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的ΔH表示生成1?mol产物的数据).
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是 ___________________________________;
(2)PCl5分解成PCl3和Cl2的热化学方程式是 __________________________________;上述分解反应是一个可逆反应.温度T1时,在密闭容器中加入0.80?mol?PCl5,反应达平衡时PCl5还剩0.60?mol,其分解率α1等于________;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2________α1(填“大于”、“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5.原因是__________________________;
(4)P和Cl2分两步反应生成1?mol?PCl5的ΔH3=________,P和Cl2一起反应生成1?mol?PCl5的ΔH4________ΔH3(填“大于”、“小于”或“等于”).
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是_____________________.
参考答案:(1)3/2Cl2(g)+P(s)===PCl3(g) ΔH=-306?kJ/mol
(2)PCl5(g)===PCl3(g)+Cl2(g) ΔH=+93?kJ/mol;25%;大于
(3)两步反应均为放热反应,降温有利于提高产率,防止产物分解
(4)-399?kJ/mol;等于
(5)PCl5+4H2O===H3PO4+5HCl
本题解析:
本题难度:一般
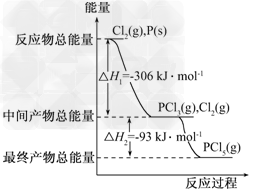
4、选择题 下列图像能正确地表达可逆反应3A(g)+B(g) 2C(g)(△H<0)的是
2C(g)(△H<0)的是
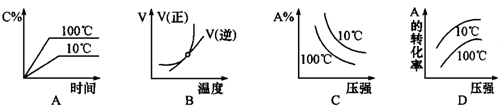
参考答案:D
本题解析:对于可逆反应3A(g)+B(g) 2C(g)△H<0,反应放热,升高温度,正、逆反应速率都增大,逆反应速率增大更多,平衡向逆反应方向移动,则C%降低,A%增大,A的转化率降低。反应物的化学计量数之和大于生成物的化学计量数之和,增大压强,平衡向正反应方向移动,则C%增大,A%降低,A的转化率增大。A、由图象可知,温度升高C%增大,说明升高温度平衡向正反应移动,图象与实际不相符,故A错误;B、由图象可知,温度升高,正反应速率增大比逆反应速率增大更多,平衡向正反应移动,图象与实际不相符,故B错误;C、由图象可知,压强越大A%降低,平衡向正反应移动。升高温度A%降低,平衡向正反应移动,图象与实际不相符,故C错误;D、由图象可知,压强越大A转化率增大,平衡向正反应移动。升高温度A的转化率降低,平衡向逆反应移动,图象与实际相符,故D正确。
2C(g)△H<0,反应放热,升高温度,正、逆反应速率都增大,逆反应速率增大更多,平衡向逆反应方向移动,则C%降低,A%增大,A的转化率降低。反应物的化学计量数之和大于生成物的化学计量数之和,增大压强,平衡向正反应方向移动,则C%增大,A%降低,A的转化率增大。A、由图象可知,温度升高C%增大,说明升高温度平衡向正反应移动,图象与实际不相符,故A错误;B、由图象可知,温度升高,正反应速率增大比逆反应速率增大更多,平衡向正反应移动,图象与实际不相符,故B错误;C、由图象可知,压强越大A%降低,平衡向正反应移动。升高温度A%降低,平衡向正反应移动,图象与实际不相符,故C错误;D、由图象可知,压强越大A转化率增大,平衡向正反应移动。升高温度A的转化率降低,平衡向逆反应移动,图象与实际相符,故D正确。
本题难度:一般
5、选择题 在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表。下列说法错误的是
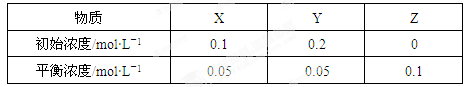
A.反应达到平衡时,X的转化率为50%
B.改变温度可以改变此反应的平衡常数
C.反应可表示为X+3Y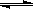 2Z,其平衡常数为1600
2Z,其平衡常数为1600
D.增大压强使平衡向生成Z的方向移动,平衡常数增大