| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《离子方程式的书写及正误判断》试题预测(2017年最新版)(二)
参考答案:C 本题解析:A、二氧化碳不能用H+表示,错误;B、氢氧化钡与硫酸反应除生成水外还生成硫酸钡沉淀,不能用H++OH-= H2O表示,错误;C、氢氧化钠与盐酸反应只生成氯化钠和水,氯化钠是易溶的强电解质,可以用H++OH-= H2O表示,正确;D、氨水是弱碱溶液,不能用OH-表示,错误,答案选C。 本题难度:一般 3、填空题 工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为 |
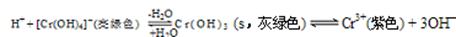
参考答案:(1)橙
(2)C D
(3)Cr2O72-+6Fe2++14H+→2Cr3++6Fe3++7H2O
(4)溶液由紫色变为亮绿色; c(Na+)>c(OH--)>c(SO42--)>c([Cr(OH)4]-)>c(H+) 。
(5)Cr3+、Cr2O72— 。
本题解析:
(1)第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O,当平衡体系的pH=2,溶液显酸性,平衡正向移动,所以c(Cr2O72—)较大,则溶液显橙色。
Cr2O72—(橙色)+H2O,当平衡体系的pH=2,溶液显酸性,平衡正向移动,所以c(Cr2O72—)较大,则溶液显橙色。
(2)当反应达到平衡状态时,任何微粒的浓度都保持不变。对每种微粒来说消耗的浓度与产生的浓度相等,即V(正)=V(逆)。溶液的颜色不变,溶液的pH不变,v正(Cr2O72—) ="1/2v" 逆(CrO42—).但不同的微粒的浓度可能相等,也可能不等。因此能说明第①步反应达平衡状态的是C、D。
(3)根据电荷守恒、原子守恒及电子守恒定律可知:第②步中Cr2O72-转变为Cr3+的离子方程式为Cr2O72-+6Fe2++14H+→2Cr3++6Fe3++7H2O。
(4)现向0.05mol·L-1的Cr2(SO4)3溶液50mL中,加入等体积0.6 mol·L-1的NaOH溶液时,c(Cr3+)="0." 1mol/L,n(Cr3+)="0.005mol" ,c(OH-)=0.3mol/L,溶液的pH>4.6所以会发生反应Cr3++3OH-=Cr(OH)3↓, 反应消耗OH-的物质的量为0.015mol,剩余OH-的物质的量为0.3mol/L×0.1L- 0.015mol=0.015mol,c(OH-)="0.015mol" ÷0.1L=0.15mol/L.大于pH=13时的c(OH-)。所以会再发生 Cr(OH)3+ H2O=H++ [Cr(OH)4]2-。因此溶液呈亮绿色。即溶液的颜色由紫色变为亮绿色。c(SO42-)=0.075mol/L,n(Na+)="0.3mol/L," c(OH--)=(0.03mol-4×0.005mol)÷0.1L="0.1mol/L" , c(H+)=Kw÷c(OH--)=10-14÷0.1=10-13mol/L, c([Cr(OH)4]-)=" 0.05mol/L" 。所以溶液中离子浓度由大到小的顺序为c(Na+)>c(OH--)>c(SO42--)>c([Cr(OH)4]-)>c(H+)。
(5)在Na[Cr(OH)4] 溶液中加入H2SO4酸化由关系式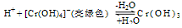
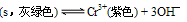 可知铬元素以Cr3+形式存在;在Na2Cr2O7的溶液中加入H2SO4酸化,由:2CrO42—(黄色)+2H+
可知铬元素以Cr3+形式存在;在Na2Cr2O7的溶液中加入H2SO4酸化,由:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O知铬元素以Cr2O72—存在。所以在Na[Cr(OH)4]和Na2Cr2O7混合后的溶液中加入H2SO4酸化,铬元素以Cr3+、Cr2O72— 形式存在。
Cr2O72—(橙色)+H2O知铬元素以Cr2O72—存在。所以在Na[Cr(OH)4]和Na2Cr2O7混合后的溶液中加入H2SO4酸化,铬元素以Cr3+、Cr2O72— 形式存在。
考点:考查化学平衡状态的判断、平衡移动、离子浓度的大小比较、离子方程式的书写的知识。
本题难度:困难
4、填空题 写出下列反应的离子方程式(每小题3分,共18分)
(1)小苏打与烧碱溶液反应:
__________________ ________
(2)钠和水反应
_______________ ___________
(3)过量的二氧化碳与氢氧化钠
________________ _________
(4)NH4HCO3溶液与足量NaOH溶液反应:
___________________ _______
(5)大理石(CaCO3)与稀HNO3反应:
_____________ _____________
(6)Al与NaOH溶液反应:
__________________ _________
参考答案:(1)HCO+OH-===H2O+CO (3分)
(2) 2Na + 2H2O ===2Na+ + 2OH-+ H2↑ (3分)
(3)CO2 + OH-=== HCO3- (3分)
(4)NH4+ + HCO3- + 2OH-=== NH3↑+ CO32- + 2H2O (3分)
(5)CaCO3 + 2H+=== Ca2+ + H2O + CO2↑ (3分)
(6)2Al+2OH-+2H2O===2AlO+3H2↑ (3分)
本题解析:本题考查离子方程式的书写,书写离子方程式关键是准确判断哪些物质用化学式表示,哪些物质用离子符号表示。只有同时满足溶于水和易电离才能用离子表示,其余的都是用化学式表示。
本题难度:一般
5、选择题 下列各项对应的电离方程式或离子方程式书写正确的是 ( )
A.NaHSO4熔融态的电离:NaHSO4=Na++HSO4-
B.NaHCO3在水中电离:NaHCO3==Na++H++CO32-
C.Cu(OH)2溶于硫酸溶液:H++OH-=H2O
D.实验室制取CO2:CO32-+2H+=CO2↑+H2O
参考答案:A
本题解析:B、碳酸为弱酸,故碳酸氢根不能拆开;
C、氢氧化铜为弱碱,不能拆开;
D、实验室用石灰石和盐酸反应制取二氧化碳,CaCO3不能拆。
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《化学平衡》.. | |