微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 现有四瓶溶液,分别是H2SO4、BaCl2、Na2SO4、Na2CO3中的一种,根据以下实验,请分别确认A、B、C、D各是什么物质?
A加入B中无反应。A加入C中有气体产生,D加入A中有沉淀产生。
则:A:________; B:________;C:_________;D:___________(每空1分)。
写出A与C反应的离子方程式
A与D反应的离子方程式。_______________ (每空2分)。
参考答案:A. H2SO4 B. Na2SO4 C. Na2CO3 D. BaCl2
2H+ +CO32- =H2O +CO2↑ SO42- +Ba2+ =BaSO4↓
本题解析:略
本题难度:简单
2、填空题 (10分)有以下物质:①Mg ②Al ③C ④稀硫酸 ⑤浓硫酸 ⑥NaOH溶液
(1)写出①与④反应的离子方程式 。
(2)既能跟④又能跟⑥反应的是 (填序号),写出它与⑥反应的化学方程式 。
(3)写出写出③与⑤反应的化学方程式 ,下列关于该反应中⑤体现的性质说法正确的是 。
a.既体现氧化性又体现酸性
b.只体现氧化性
c.只体现酸性
d.体现吸水性
参考答案:(1)Mg+2H+
本题解析:
本题难度:一般
3、填空题 (10分)ClO2气体是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒.
(1)工业上可以通过下列方法制取ClO2,请完成该化学反应方程式: 2KClO3+SO2=2ClO2+________。
(2)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(已知:2S2O32-+I2=S4O62-+2I-)
Ⅲ.加硫酸调节水样pH至1~3。操作时,不同pH环境中粒子种类如下图所示:
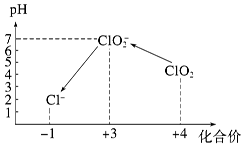
请回答:
①操作Ⅰ中反应的离子方程式是______________________________。
②确定操作Ⅱ完全反应的现象是______________________________。
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是__________________。
④若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol·L-1的Na2S2O3溶液10 mL,则水样中ClO2的浓度是________mg·L-1。
参考答案:(1)K2SO4(2分)
(2)①2ClO2+2I-=2ClO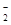 +I2(2分);②蓝色消失,半分钟内不变色(2分);
+I2(2分);②蓝色消失,半分钟内不变色(2分);
③ClO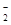 +4I-+4H+=Cl-+2I2+2H2O(2分);④0.675(2分)
+4I-+4H+=Cl-+2I2+2H2O(2分);④0.675(2分)
本题解析:(1)工业上可以通过KClO3与SO2发生氧化还原反应产生ClO2,根据氧化还原反应中电子转移数目相等及质量守恒定律,可知该化学反应方程式是: 2KClO3+SO2=2ClO2+K2SO4;①操作Ⅰ中ClO2将I-氧化为I2,反应的离子方程式是2ClO2+2I-=2ClO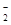 +I2; ②操作Ⅱ完全反应时溶液中的I2反应完全,因此溶液的颜色由蓝色变为无色,且半分钟内不变色;③在操作Ⅲ过程中,溶液又呈蓝色,是由于ClO
+I2; ②操作Ⅱ完全反应时溶液中的I2反应完全,因此溶液的颜色由蓝色变为无色,且半分钟内不变色;③在操作Ⅲ过程中,溶液又呈蓝色,是由于ClO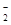 在碱性环境中将I-又氧化为I2,I2遇淀粉变蓝色,反应的离子方程式是ClO
在碱性环境中将I-又氧化为I2,I2遇淀粉变蓝色,反应的离子方程式是ClO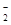 +4I-+4H+=Cl-+2I2+2H2O;④根据反应方程式可得关系式是:2ClO2~I2~2S2O32-。n(S2O32-)= 1.0×10-3 mol/L × 0.01L=1.0×10-5mol;所以n(ClO2)= 1.0×10-5mol;m(ClO2)= 1.0×10-5mol×67. 5×103mg/mol=0.675mg;若水样的体积为1.0 L,所以水样中ClO2的浓度是0.675mg÷1L =0.675mg/L。
+4I-+4H+=Cl-+2I2+2H2O;④根据反应方程式可得关系式是:2ClO2~I2~2S2O32-。n(S2O32-)= 1.0×10-3 mol/L × 0.01L=1.0×10-5mol;所以n(ClO2)= 1.0×10-5mol;m(ClO2)= 1.0×10-5mol×67. 5×103mg/mol=0.675mg;若水样的体积为1.0 L,所以水样中ClO2的浓度是0.675mg÷1L =0.675mg/L。
考点:考查氧化还原反应方程式的配平、滴定终点的判断、关系式法在化学计算中的应用的知识。
本题难度:一般
4、填空题 ⑴下列物质:①熔融氯化钠 ②盐酸 ③纯醋酸(CH3COOH) ④碳酸钙 ⑤酒精 ⑥二氧化碳 ⑦硫酸氢钠固体 ⑧铜 ⑨碳酸氢钠固体⑩氢氧化钡溶液,属于电解质的是 , 属于非电解质的是 ,能导电的是 。(用序号填空)
⑵写出物质③和⑨在水中反应的离子方程式: 。
⑶将物质⑦配制成溶液,逐滴滴入⑩中至Ba2+恰好沉淀完全,写出离子方程式: 。
参考答案:⑴①③④⑦⑨,⑤⑥,①②⑧⑩
⑵HCO3?+CH3COOH=H2O+CO2↑+CH3COO?
⑶H++SO42?+Ba2++OH?= BaSO4↓+ H2O
本题解析:⑴电解质是在水溶液或熔融状态下能导电的化合物,非电解质是在水溶液和熔融状态下都不能导电的化合物。根据定义可以作答。
⑵③纯醋酸(CH3COOH)不能拆成离子形式,⑨碳酸氢钠固体溶于水电离出HCO3?和Na+
⑶⑦NaHSO4= Na++ H++SO42?,Ba(OH)2=Ba2++2OH?;NaHSO4与Ba(OH)2反应,实质是H+与OH?,Ba2+与SO42?的反应。
考点:物质的分类和离子方程式的书写。
本题难度:一般
5、选择题 下列离子方程式书写正确的是
A.NaHSO4溶液与Ba(OH)2溶液反应至中性: H++SO42-+Ba2++OH- = BaSO4↓+H2O
B.钢铁发生吸氧腐蚀的正极反应式:O 2+ 4e-+2H2O=4OH—
C.足量的溴化亚铁和少量的氯气反应:2Fe2++4Br-+3Cl2=3Fe3++2Br2+6Cl-
D.用铁作电极电解饱和食盐水:2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-