微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在0.1mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH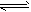 CH3COO-+H+,下列叙述正确的是
CH3COO-+H+,下列叙述正确的是
[? ]
A.加入水时,平衡向逆反应方向移动
B.加入少量CH3COONa固体,平衡向正反应方向移动
C.加入少量0.1mol·L-1HCl溶液,平衡向逆反应方向移动,溶液中c(H+)增大
D.加入少量NaOH固体,平衡向正反应方向移动
参考答案:CD
本题解析:
本题难度:一般
2、选择题 下列各组数据中,其比值为2:1的是( )
A.氨水与(NH4)2SO4溶液混合后pH=7的溶液中,c(NH4+):c(SO42-)
B.相同温度下,0.2mol?L-1乙酸溶液与0.1mol?L-1乙酸溶液中c(H+)之比
C.Na2CO3溶液中,c(Na+):c(CO32-)
D.pH=12的Ba(OH)2溶液与pH=12的KOH溶液中,c[Ba(OH)2]:c(KOH)
参考答案:A、氨水与(NH4)2SO4溶液混合后pH=7,则c(H+)=c(OH-),由电荷守恒可知c(NH4+)+c(H+)=c(OH-)+2c(SO42-),故c(NH4+)=2c(SO42-),c(NH4+):c(SO42-)=2:1,
故A正确;
B、因乙酸为弱酸,浓度越小,电离程度越大,则0.2mol?L-1乙酸溶液与0.1mol?L-1乙酸溶液中c(H+)之比不等于2:1,应小于2:1,故B错误;
C、由化学式为Na2CO3,n(Na+)=2n(CO32-),但CO32-的水解,则c(Na+):c(CO32-)>2:1,故C错误;
D、强碱溶液,pH=12,则c(OH-)=0.01mol/L,故c[Ba(OH)2]=0.005mol/L,c(KOH)=0.01mol/L,c[Ba(OH)2]:c(KOH)=1:2,故C错误;
故选A.
本题解析:
本题难度:一般
3、选择题 下列物质中含有自由移动Cl-的是
A.KClO3固体
B.Cl2
C.HCl气体
D.KCl溶液
参考答案:D
本题解析:分析:A.KClO3固体是由钾离子和氯酸根离子构成;
B.Cl2由分子构成;
C.HCl气体由氯化氢分子构成;
D.KCl由钾离子和氯离子构成;
解答:
A.KClO3固体只有在水溶液中或熔融状态下,才可电离出自由移动的钾离子和氯酸根离子.故A错误;
B.Cl2是单质,只有分子,没有离子.故B错误;
C.HCl只有在水溶液中,才可电离出自由移动的H+和Cl-,HCl气体只有分子.故C错误;
D.KCl在水溶液中,在水分子的作用下,电离出自由移动的钾离子和氯离子,电离方程式为:KCl=K++Cl-.故D正确;
故选D.
点评:解答该题一定注意自由移动的离子产生的条件,以及产生何种离子.
本题难度:困难
4、选择题 在0.1 mo l · L-1的NH3·H2O溶液中,下列关系式正确的是(?).
A c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+)
B c(NH4+)>c(NH3·H2O)>c(OH-)>c(H+)
C c(NH3·H2O)>c(NH4+)=c(OH-)>c(H+)?
D c(NH3·H2O)>c(NH4+)>c(H+)>c(OH-)
参考答案:A
本题解析:在NH3 ?H2O溶液中存在电离电离平衡:
NH3 ?H2O NH4++OH—和H2O
NH4++OH—和H2O H++OH-且NH3 ?H2O的电离程度很小,故 c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+)。
H++OH-且NH3 ?H2O的电离程度很小,故 c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+)。
本题难度:简单
5、选择题 醋酸的下列性质中,可以证明它是弱电解质的是?
[? ]
A.醋酸溶 液可与纯碱溶液反应产生CO2
B.相同pH的醋酸溶液和盐酸分别跟同样颗粒大小的锌反应时,产生H2的起始速率相等
C.10?mL?1?mol/L醋酸溶液恰好与10?mL?1?mol/L?NaOH溶液完全反应
D.在相同条件下,醋酸溶液的导电性比盐酸溶液的弱
参考答案:D
本题解析:
本题难度:简单