微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 室温下有下列四种溶液:①0.1 mol/L氨水?②0.1 mol/L NH4Cl溶液?③混合溶液:盐酸和NH4Cl的浓度均为0.1 mol/L?④混合溶液:NaOH和氨水的浓度均为0.1 mol/L。四种溶液中c(NH4+)由大到小排列正确的是
A.②③④①
B.②①③④
C.③②④①
D.③②①④
参考答案:D
本题解析:氨水是弱碱,存在电离平衡;氯化铵是强电解质,完全电离,但氯化铵水解显酸性;盐酸的存在能抑制氯化铵水解;氢氧化钠的存在,能抑制氨水的电离,所以答案选D。
本题难度:一般
2、选择题 取pH值均等于2的盐酸和醋酸各100ml分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是
[? ]
A.醋酸与锌反应放出氢气多
B.盐酸和醋酸分别与锌反应放出的氢气一样多
C.醋酸与锌反应速率大
D.盐酸和醋分别与锌反应的速度一样大
参考答案:C
本题解析:
本题难度:一般
3、选择题 下列说法正确的是
A.溶液的PH值越小,表明溶液中含有的H+ 的数目越多
B.由0.1 mol·L-1一元碱BOH溶液的pH = 10,可推知BOH溶液中存在关系BOH→B+ + OH-
C.0.1 mol·L-1的醋酸PH为a,0.01 mol·L-1的醋酸PH值为b,则a+1>b
D.已知酸性HF〉HAC,pH相等的NaF与 KAC溶液中,[c(Na+)-c(F-) < c(K+)-c(AC-)]
参考答案:C
本题解析:
正确答案:C
A.不正确,溶液的PH值越小,表明溶液中含有的H+ 的浓度越大;H+数目多少还与溶液的体积有关;
B.不正确,由0.1 mol·L-1一元碱BOH溶液的pH = 10,可推知BOH是弱电解质,溶液中存在关系BOH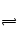 B+ + OH-
B+ + OH-
C.正确,0.1 mol·L-1的醋酸PH为a,0.01 mol·L-1的醋酸PH值为b,则a+1>b
D.不正确,已知酸性HF〉HAC,pH相等的NaF与 KAC溶液中, c(Na+)-c(F-) = c(K+)-c(AC-)=c(OH―)-c(H+),即电荷守恒。
本题难度:一般
4、选择题 在相同温度时,100 mL 0.01 mol/L的醋酸溶液与10 mL 0.1 mol/L的醋酸相比较,下列数值中,前者大于后者的是
A.H+的物质的量
B.醋酸的电离常数
C.中和时所需NaOH的物质的量
D.加足量锌粉产生氢气的质量