| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《化学平衡》高频试题巩固(2017年最新版)(四)
参考答案:B 本题解析:略 本题难度:一般 2、填空题 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)
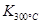 > >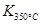 ,则该反应是?热反应。 ,则该反应是?热反应。(2)图中表示NO2的变化的曲线是?。用O2表示从0~2 s内该反应的平均速率v=?。  (3)能说明该反应已达到平衡状态的是?。 a.v(NO2)=2v(O2)? b.容器内压强保持不变 c.v逆(NO)=2v正(O2)? d.容器内密度保持不变 (4)为使该反应的反应速率增大,且平衡向正反应方向移动的是?。 a.及时分离出NO2气体? b.适当升高温度 c.增大O2的浓度? d.选择高效催化剂 参考答案:(1)K= 本题解析:(1)化学常数是在一定条件下的可逆反应中,当可逆反应反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的方程式可知,该反应的平衡常数是K= 本题难度:一般 3、选择题 25.在一定条件下,将1mol CO和2mol 水蒸气混合后发生如下变化:CO(g)+H2O(g) CO2(g)+H2(g),若反应达平衡时测得CO转化率为40%,则该条件下该反应的平衡常数为 |
参考答案:C
本题解析:CO(g) + H2O(g)  CO2(g) + H2(g)
CO2(g) + H2(g)
始 1mol 2mol 0 0
转 0.4mol 0.4mol 0.4mol 0.4mol
平 0.6mol 1.6mol 0.4mol 0.4mol
K=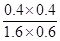 =0.17
=0.17
考点:平衡常数的计算
点评:掌握平衡常数的计算方法是本体解题的关键,本题为简单题。
本题难度:一般
4、选择题 可逆反应2SO2(g)+O2(g)
参考答案:
本题解析:
本题难度:一般
5、填空题 为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。
已知:
2CO(g)+O2(g)=2CO2(g);ΔH=-566kJ·moL-1
2H2(g)+O2(g)=2H2O(g);ΔH=-483.6KJ·moL-1
H2O (g)=H2O(l);ΔH=-44.0KJ·moL-1
(1)氢气的燃烧热△H=__________kJ·moL-1
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式__________________________
(3)往1L体积不变的容器中加入1.00mol CO和1.00mol H2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为__________;反应达到平衡后,升高温度,此时平衡常数将
__________(填“变大”、“不变”或“变小”),平衡将向__________(填“正”或“逆”)方向移动
(4)为了提高CO的转化率,可采取的措施是__________。
A.增大的CO浓度 B.增大的H2O(g)浓度 C.使用催化剂 D.降低温度
(5)H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是____________________
参考答案:(1)-285.8
(2)CO(g)+H2O(g)==CO2(g)+H2(g) △H=-41.2kJ/mol
(3)50%;变小;逆
(4)BD
(5)H2+2OH--2e-==2H2O
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《物质的组成.. | |