| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《化学平衡》高频试题巩固(2017年最新版)(六)
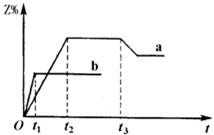
参考答案:(15分)(每空3分) 本题解析:(1)根据化学反应可写出化学平衡常数表达式为[CH3OH]/[CO][H2]2,根据图像,温度升高,甲醇的物质的量减少,说明平衡逆向进行,升高温度,平衡向吸热反应方向移动,所以该反应的正向是放热反应,则升高温度,K值将减小; 本题难度:困难 4、选择题 两体积相同的密闭容器中均充入1mol?X和1mol?Y,分别在300℃和500℃下发生如下反应:X(g)+Y(g) |
参考答案:C
本题解析:
本题难度:简单
5、填空题 反应 (△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示
(△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示
回答问题:
⑴反应的化学方程中a∶b∶c为_______________;
⑵A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为____________;
⑶B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最小的是______,其值是______;
⑷由第一次平衡到第二次平衡,平衡移动的方向是____________,采取的措施是____________;
⑸比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低;T2______T3(填“<”“>”“=”)判断的理由是____________。
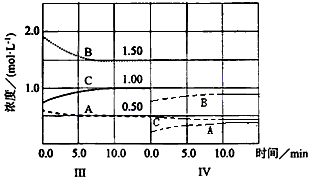
⑹达到第三次平衡后,将容器的体积扩大一倍,假定10min后达到新的平衡,请在下图中用曲线表示第Ⅳ阶段体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、C)。 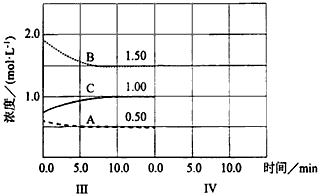
参考答案:
⑴1∶3∶2
⑵vⅠ(A) >vⅡ(A) >vⅢ(A)
⑶αⅢ(B);0.19
⑷向右移动,将C从平衡混合物中液化分离出去
⑸<;因为该反应为放热反应
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《物质的组成.. | |