微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 在真空密闭容器内加入a mol PH4I固体,在一定温度下发生如下反应:
PH4I(s)?PH3(g)+HI(g)
4PH3(g)?P4(g)+6H2(g)
2HI(g)?H2(g)+I2(g)
以上三反应建立平衡后,测得HI为b mol、I2(g)为c mol、H2为d mol.
(1)平衡后,容器内P4(g)和PH3的物质的量(用代数式表示):n(P4)=______;n(PH3)=______.
(2)a、b、c三者服从a>______(填b、c的代数式);b、c、d三者的关系服从b>______(填c、d的代数式).
(3)平衡后,增大压强,容器内n(I2)______,n(PH4I)______(填增大、减小、不变).
参考答案:建立平衡后,测得HI为bmol、I2(g)为cmol、H2为dmol,根据化学反应,则
PH4I(s)?PH3(g)+HI(g)
b+2cb+2cb+2c
4PH3(g)?P4(g)+6H2(g)
2(d-c)3 d-c6d-c
2HI(g)?H2(g)+I2(g)
2c c c
(1)平衡后,容器内P4(g)的物质的量是d-c6mol,PH3的物质的量是(b+2c)mol-2(d-c)3mol=(8c3+b-2d3)mol,
故答案为:d-c6;(8c3+b-2d3);
(2)在真空密闭容器内加入amol PH4I固体,由于反应是可逆的,所以a>b+2c;8c3+b-2d3>0,即b>2d3-8c3,
故答案为:a>b+2c;b>2d3-8c3;
(3)平衡后,增大压强,平衡PH4I(s)?PH3(g)+HI(g)逆向移动,平衡4PH3(g)?P4(g)+6H2(g)逆向移动,平衡2HI(g)?H2(g)+I2(g)不移动,所以结果是容器内n(I2)减小,n(PH4I)增大,
故答案为:减小;增大.
本题解析:
本题难度:简单
2、选择题 COCl2(g) CO(g)+Cl2(g);△H>0。当反应达到平衡时,下列措施:①升温;②恒容通入惰性气体;③增加CO的浓度;④减压;⑤加催化剂;⑥恒压通入惰性气体。能提高COCl2转化率的是
CO(g)+Cl2(g);△H>0。当反应达到平衡时,下列措施:①升温;②恒容通入惰性气体;③增加CO的浓度;④减压;⑤加催化剂;⑥恒压通入惰性气体。能提高COCl2转化率的是
[? ]
A.①②④
B.①④⑥
C.②③⑥
D.③⑤⑥
参考答案:B
本题解析:
本题难度:一般
3、选择题 关于化学平衡常数的叙述正确的是( )
A.温度一定,一个化学反应的平衡常数是一个常数
B.两种物质反应,不管怎样书写化学方程式,平衡常数不变
C.温度一定时,对于给定的化学反应,正、逆反应的平衡常数互为相反数
D.浓度商Qc<Kc,?v(正)<v(逆)
参考答案:A
本题解析:
本题难度:一般
4、计算题 将一定量的SO2和含0.7 mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2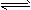 2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数) 请回答下列问题:
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数) 请回答下列问题:
(1)判断该反应达到平衡状态的标志是__________。(填字母)
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.容器中气体的压强不变
d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)求该反应达到平衡时SO2的转化率(用百分数表示)。
(3)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?
参考答案:(1)bc
(2)消耗O2的物质的量:0.7 mol- =0.45mol
=0.45mol
生成SO3的物质的量:0.45mol×2=0.9 mol
SO2和SO3的物质的量之和: =0.95 mol
=0.95 mol
反应前SO2的物质的量:0.95mol
SO2的转化率: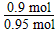 ×100%=94.7%
×100%=94.7%
(3)在给定的条件下,溶液呈强酸性,BaSO3不会存在。因此BaSO4的质量为
0.9 mol×0.05×233g·mol-1≈10.5g。
本题解析:
本题难度:一般
5、选择题 下列事实不能用勒夏特列原理(平衡移动原理)解释的是(?)
①氯化铁溶液加热蒸干最终得不到氯化铁固体;
②铁在潮湿的空气中容易生锈;
③实验室可用排饱和食盐水的方法收集氯气;
④保存FeCl2溶液时向溶液中加入少量铁粉
⑤钠与氯化钾共融制备钾Na(L)+KCl(L)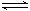 K(g)+NaCl(L);
K(g)+NaCl(L);
⑥二氧化氮与四氧化二氮的平衡体系,加压缩小体积后颜色加深
A.①②③
B.②④⑥
C.③④⑤
D.②⑤⑥
参考答案:B
本题解析:勒夏特列原理是化学平衡移动原理,适用对象:1、所有的平衡,如化学反应平衡、电离平衡、水解平衡、溶解平衡、络合平衡等;2、勒夏特列原理的适用因素只有维持平衡状态的因素发生改变时,才能应用勒夏特列原理。若改变的不是维持平衡状态的因素,平衡不会移动,也就不必应用勒夏特列原理。
②铁在潮湿的空气中容易生锈,是一个化学变化;
④保存FeCl2溶液时向溶液中加入少量铁粉,防止FeCl2被氧化;
⑥二氧化氮与四氧化二氮的平衡体系,加压缩小体积后颜色加深,平衡不动,无法用勒夏特列原理解释,颜色加深因为体积缩小,浓度变大,颜色加深。
本题难度:简单