微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 同周期中A、B、C、D、E、F为原子序数依次增大的短周期元素。已知:A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应,均生成盐和水。请完成下列问题:
(1)根据以上条件一定能判断出的元素有几种,请在下列横线上写出相应的元素符号:
A._____________,B._____________,C._____________,
D._____________,E._____________,F._____________。
(2)已知D单质在F单质中燃烧可能生成两种化合物,请分别写出生成两种化合物的化学方程式: ____________________________________;____________________________________。
(3)若1 mol F的最高价氧化物对应水化物与C的最高价氧化物对应水化物恰好完全反应,则等物质的量的C的最高价氧化物与A的最高价氧化物对应水化物反应消耗_____________mol A的最高价氧化物对应水化物。
参考答案:(1)Na? Mg? Al? P? S? Cl? (2)2P+3Cl2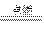 2PCl3? 2P+5Cl2
2PCl3? 2P+5Cl2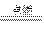 2PCl5? (3)
2PCl5? (3)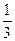
本题解析:(1)A、C、E三种元素的最高价氧化物对应的水化物之间两者皆反应生成盐和水,那么其中两种最高价氧化物对应水化物应为酸和碱,而另外一种水化物既能与酸反应,又能与碱反应,必为两性氧化物,中学范围内只有Al2O3了。又知A、B、C、D、E、F同周期,且原子序数依次增大,则C应为Al,A为金属,F为非金属,C之前的A、B应依次为Na、Mg。A、C、F最外层电子数共为11,则F最外层电子数为11-1-3=7,所以F应为Cl元素。
(2)D在周期表中位置在Al、Cl之间,可能为Si、P,不可能为S,因为E的序数大于D小于F,那么在Cl2中燃烧生成两种产物的应为P。
3Cl2+2P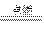 2PCl3
2PCl3
2P+5Cl2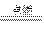 2PCl5
2PCl5
(3)A、F最高价氧化物对应水化物分别为NaOH、HClO4,与C最高价氧化物对应水化物Al(OH)3的反应分别为:
NaOH+Al(OH)3====NaAlO2+2H2O
3HClO4+Al(OH)3====Al(ClO4)3+3H2O
若HCl为1 mol,则Al(OH)3为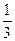 mol,消耗NaOH
mol,消耗NaOH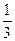 mol。
mol。
本题难度:简单
2、填空题 下表标出的是元素周期表的一部分元素,回答下列问题:(10分)
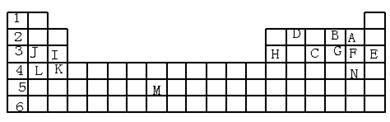
(1)表中用字母标出的14种元素中,化学性质最不活泼的是?(用元素符号表示,下同),主族元素中金属性最强的是?,非金属性最强是?,常温下单质为液态的非金属元素是?;属于过渡元素的是?(该空用字母表示)。
(2)B、F、C气态氢化物的化学式分别为?????,
其中以?最不稳定。
(3)第三周期中原子半径最小的是?。
参考答案:(1) Ar? K? F? Br? M?
(2)H2O? HCl? PH3?PH3?(3)Cl
本题解析:考查元素周期表的结构和元素周期律的应用。
(1)根据元素在周期表中的位置可判断E是稀有气体元素Ar,化学性质最不活泼。金属性最强的元素位于第IA的L,L是K。非金属性最强的是位于第ⅦA的A,即F。温下单质为液态的非金属元素是Br,即是N。周期表中第3列至第12列共10列元素属于过渡元素,所以属于过渡元素的是M。
(2)B、F、C分别是O、Cl、P,最低价分别是-1价、-1价和-3价,因此气态氢化物的化学式分别为H2O、HCl、PH3。非金属性越强,氢化物的稳定性越强,三种元素的非金属性强弱顺序为O>Cl>P,所以PH3的稳定性最差。
(3)同周期自左向右原子半径逐渐减小,所以第三周期中原子半径最小的是Cl。
本题难度:一般
3、选择题 目前含有元素硒(Se)的保健品已开始涌入市场,已知它与氧同主族,而与钙同周期,下列关于硒的有关描述中不正确的是
A.原子序数22
B.最高价氧化物为SeO3,为酸性氧化物
C.原子半径比钙小
D.气态氢化物化学式为H2Se
参考答案:A
本题解析:略
本题难度:简单
4、选择题 下列说法中,正确的是
A.所有主族 元素正化合价数等于它的族序数
元素正化合价数等于它的族序数
B.VIIA族元素的原子随核电荷数的增加,得电子能力逐渐减弱
C.IA、IIA族元素的阳离子与同周期稀有气体元素的原子 具有相同的核外电子排布
具有相同的核外电子排布
D.前三周期元素中共有12种非金属元素(包括稀有气体元素)
参考答案:B
本题解析:略
本题难度:简单
5、选择题 核电荷数大于10的某短周期元素,其原子最外电子层所含有的电子数是次外层所含有的电子数的一半,有关该元素的单质或化合物的描述不正确的是( )。
A.该元素在第3周期第ⅣA族
B.该元素的单质在常温下性质稳定,不易与水反应
C.该元素的氧化物不与酸反应,可与强碱的水溶液反应
D.该元素在地壳中的含量大,居所有元素的第二位
参考答案:C
本题解析:核电荷数大于10的某短周期元素只能是第3周期元素,又因为原子最外电子层所含有的电子数是次外层所含有的电子数的一半,故该元素是硅。硅元素位于周期表中第3周期第ⅣA族,在常温下性质稳定,不易与水反应,该元素在地壳中的含量大,居所有元素的第二位,其氧化物SiO2能与HF反应,能与强碱氢氧化钠溶液反应,A、B、D正确,C错误。
本题难度:一般