微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 根据原子序数判断 下列各组元素中能形成AB2型化合物的是
下列各组元素中能形成AB2型化合物的是
A.6和10
B.12和8
C.10和13
D.12和9
参考答案:D
本题解析:略
本题难度:一般
2、填空题 若X、 Y两种元素在周期表中位于同一主族,且相隔一个周期,并有m=n>0。在一定条件下有下列反应(未配平):?Xm + Yn + H2O?→? HXO3 + HY
请回答:(1)该反应的还原剂的电子式为___________________。
(2)配平上述化学方程式(用化学式表示):?
(3)若某化学反应如下:(未配平)
KX?+ Yn + H2O?→? KXO3 + Xm?+ HY + KY
若KXO3和Xm的化学计量数均为1,则Yn的化学计量数为____________。
在下面化学式上标出电子转移的方向和数目
KX?+ Yn + H2O?→
(4)已知:在反应中,若氧化反应和还原反应发生在同一分子内部处于同一化合价的同种元素上,使该元素的原子(或离子)一部分被氧化,另一部分被还原。这种自身的氧化还原反应称为歧化反应。实验室模拟KXO3的制法如下:
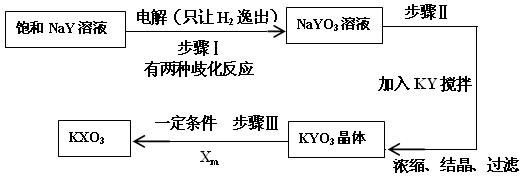
①在进行步骤Ⅰ实验时,有学生主张电解装置用U形管,有的学生主张用烧杯,你认为用哪种仪器更合适______________(填名称)。
②步骤Ⅰ的阴极电极反应式为(用化学式表示):_____________________。
③步骤Ⅰ中生成NaYO3的歧化反应的离子方程式为(用化学式表示): ____________。
④步骤Ⅱ中向NaYO3的溶液中加入粉末状的KY,搅拌后生成KYO3。已知有2L 3mol/L的NaYO3溶液,则至少需要加入__________mol KY粉末可将溶液中的YO3-离子沉淀至浓度变为0.1mol/L。(已知Ksp(KYO3)= 0.366,计算结果保留两位小数,加入KY粉末后溶液体积不变 )、
参考答案:(1):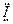 :
: 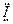 :(1分)(2)I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl(2分)
:(1分)(2)I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl(2分)
(3)4(2分)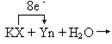 (1分)(4)①烧杯(2分)②2H+ + 2e- = H2↑或2H2O + 2e- = 2OH- +H2↑(2分)③3Cl2 + 6OH- = 5Cl- + ClO3- + 3H2O(2分)④13.12(2分)
(1分)(4)①烧杯(2分)②2H+ + 2e- = H2↑或2H2O + 2e- = 2OH- +H2↑(2分)③3Cl2 + 6OH- = 5Cl- + ClO3- + 3H2O(2分)④13.12(2分)
本题解析:略
本题难度:一般
3、选择题 日本福岛第一核电站发生严重的核辐射泄漏,日本政府向核电站附近居民发放碘片(127I),以降低放射性碘对人体的伤害。已知放射性碘(131I)的核电荷数为 53,则下列说法正确的是( )
A.127I与131I互为同素异形体
B. 131I和131Xe互为同位素
C.131I 原子的中子数为78
D.127I 原子和131I 原子的相对原子质量相同
参考答案:C
本题解析:A项:127I原子和放射性131I质子数相同,因此互为同位素,故错;B项:互为同位素的前提是同一种元素,故错;D项:原子的相对分子质量约等于质量数,故错。故选C。
点评:解题的关键是对有关原子知识的掌握情况,理解在原子中,核电荷数、质子数、核外电子数、相对原子质量、中子数之间的关系,才能顺利解答.属基础性知识考查题。
本题难度:简单
4、选择题 下列说法中正确的是( )。
A.在周期表中金属与非金属的分界处可以找半导体材料
B.H2S、H2Se、HF的热稳定性依次增强
C.NaOH、KOH、Mg(OH)2的碱性依次减弱
D.Cl、S、N元素的非金属性依次增强
参考答案:A
本题解析:非金属性越强的元素其对应的气态氢化物的稳定性越强,金属性越强的元素其对应的碱的碱性越强。H2Se、H2S、HF的热稳定性依次增强;KOH、NaOH、Mg(OH)2的碱性依次减弱;S的非金属性小于Cl。
本题难度:一般
5、选择题 无机化学命名委员会在1989年作出决定,把长式元素周期表原先的主、副族及族号取消,由左到右改为18列。按此规定,下列说法中错误的是(?)
A.第15列元素的最高价氧化物的化学式是R2O3
B.第1列和第17列元素单质熔、沸点变化趋势相反
C.第11列中肯定没有非金属元素
D.在18列元素中,第3列的元素种类最多
参考答案:A
本题解析:考查元素周期表的结构。根据周期表的结构可知,第15列元素是第ⅤA元素,最高价是+5价,所以最高价氧化物的化学式为R2O5,A不正确。第1列是碱金属,自上而下熔沸点逐渐降低,第17列是卤素,自上而下熔沸点逐渐升高,B正确。第11列是第ⅢA元素,全部是金属元素,C正确。第3列包括镧系和锕系元素,所以元素种类最多。答案选A。
本题难度:一般