|
|
|
高考化学必考知识点《离子方程式的书写及正误判断》高频考点强化练习(2017年最新版)(五)
2017-07-10 19:33:31
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (每小题3分,共15分)
(1)实验室制取氯气反应的离子方程式为
(2)工业上制取漂白粉反应的化学方程式为
(3)配平: KClO3+ H2C2O4+ H2SO4 → K2SO4+ ClO2↑+ CO2↑+ H2O
(4)二氧化碳气体通过一定量的过氧化钠固体,固体增重2.8g时,放出热量为Q KJ
则此反应的热化学方程式为
(5)标况下3.136 L Cl2通入0.1 L FeBr2溶液中,测得溶液Br-中消耗了三分之二,则此时总反应的离子方程式为
2、选择题 下列离子方程式书写正确的是 ( )
A.用碳棒作电极电解饱和AlCl3溶液:2C1-+2H2O
B.亚硫酸钠溶液使酸性高锰酸钾溶液褪色:
5SO32-+6H++2MnO4-
C.向偏铝酸钠溶液中通人过量CO2:
2AlO2-+CO2+3H2O
D.碳酸氢钙溶液中加人少量NaOH溶液:
| Ca2++2HCO3-+2OH- CaCO3↓+CO32-+2H2O
3、选择题 下列离子方程式的书写正确的是( )
A.稀硫酸与Ba(OH)2溶液反应: SO42-+Ba2+==BaSO4↓
B.向氯化亚铁溶液中通入Cl2:Fe2++Cl2==Fe3++2Cl-
C.铁和稀盐酸的反应:2Fe+6H+==2Fe3++3H2↑
D.碳酸镁与稀硫酸的反应:MgCO3+2H+==Mg2++H2O+CO2↑
|
4、实验题 二氧化氯(ClO2)在常温下是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用下图所示装置模拟工业制取并收集ClO2。由于该反应是吸热反应,所以在情况下有利于该反应自发进行
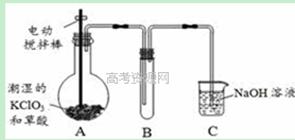
(1)A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式: 。
(2)A必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、 ;B装置必须放在冰水浴中,其原因是 。
(3)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:① ;② ;③洗涤;④干燥。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知2 Na2S2O3 + I2=Na2S4O6 + 2NaI)
①配制100 mL c mol/LNa2S2O3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒外还有: 。
②写出步骤2中发生反应的离子方程式 。
③原ClO2溶液的浓度为 g / L(用步骤中的字母代数式表示)。
④若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果 。
若滴定开始仰视读数,滴定终点时正确读数,则测定结果 。
(填“偏高”“偏低”或“不变” )
5、选择题 能正确表示下列各组溶液混合后,所得液体恰好呈中性的离子方程式是 ( )
①Ba(OH)2和NaHSO4:Ba2+ +2OH- +2H+ +SO42—=BaSO4↓+ 2H2O
②Ba(OH)2和NaHSO4:Ba2+ + OH-+ H++ SO42—=BaSO4↓+ H2O
③ Ba(OH)2和KAl(SO4)2:2Ba2+ + 4OH-+ Al3++ 2SO42-=2BaSO4↓+ AlO2-
④Ba(OH)2和KAl(SO4)2:3Ba2+ + 6OH-+ 2Al3++ 3SO42-=3BaSO4↓+2Al(OH)3↓
A.③④
B.②④
C.①③
D.①④
