|
|
|
高考化学必考知识点《离子方程式的书写及正误判断》高频考点强化练习(2017年最新版)(七)
2017-07-10 19:33:31
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列表示正确的是
A.用盐酸和淀粉-KI试纸检验碘盐中的KIO3 :IO3-+5I-+6H+=3I2+3H2O
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=-566.0KJ/mol
C.Fe(OH)3溶于氢碘酸:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
D.在某钠盐溶液中含有等物质的量的Cl-、I-、AlO2-、CO32-、NO3-、SiO32-中若干种,当加入过量的盐酸产生气泡,溶液颜色变深,阴离子种数减少3种,则原溶液中一定有CO32-
|
2、实验题 (10分)某化学兴趣小组在探究次氯酸钠溶液的性质时发现:
往过量FeSO4溶液中滴入几滴NaClO溶液,并加入适量硫酸,溶液立即变黄。
请你协助他们完成该反应还原产物的探究。
(1)甲同学推测该反应的还原产物为Cl2;乙同学推测该反应的还原产物为 。
(2)假设乙同学的推测是正确。
写出过量FeSO4溶液中,滴入几滴NaClO溶液,并加入适量硫酸的离子方程式:
。
请你设计一个实验方案,验证乙同学的推测是正确的。
要求在答题卡上按下表格式写出实验步骤、预期现象和结论(可以不填满):
实验操作
| 预期现象和结论
| 步骤1:取上述反应后的溶液少许于试管A中,
。
|
| 步骤2:
。
|
| 步骤3:
。
|
|
3、选择题 下列各组物质中,因为反应条件或用量不同而发生不同化学反应的是( )
①C与O2 ②Na与O2 ③Fe与Cl2 ④AlCl3溶液与氨水
⑤CO2与NaOH溶液 ⑥Cu与硝酸 ⑦AgNO3溶液与氨水
A.除③外
B.除③⑦外
C.除③④外
D.除⑥⑦外
|
4、填空题 (1)向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液中会发生如下反应:Mn2++ S2O82-+H2O→MnO4-+SO42一十H+该反应常用于检验Mn2+的存在。其特征现象是 。若反应中有0.1 mol还原剂参加反应,则消耗氧化剂的物质的量为 mol。
(2)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有 。
(3)将NaBiO3固体(黄色微溶)加入到MnSO3和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应: NaBiO3+ MnSO4+ H2S04→ Na2S04+ Bi2(SO4)3+ NaMnO4+ H2O。
①配平上述反应的化学方程式;
②上述反应中还原产物是 。
③用单线桥表示该氧化还原反应 。
(4)S2O82-在一定条件下,可转变为S2O32-,写出往K2S2O3中滴加稀硫酸的离子方程式: 。
5、填空题 (18分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能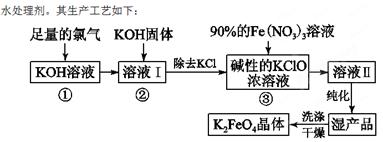
(1)反应①应在温度较低的情况下进行。因在温度较高时KOH与Cl2反应生成的是KClO3。写出在温度较高时KOH与Cl2反应的化学方程式 ,该反应的氧化产物是 。
(2)在溶液Ⅰ中加入KOH固体的目的是 (填编号)。
A.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为KClO
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为 来源:www.91exam.org; 。
(4)如何判断K2FeO4晶体已经洗涤干净 。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:
___FeO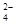 +____H2O — ____Fe(OH)3(胶体)+____O2↑+____OH-。
+____H2O — ____Fe(OH)3(胶体)+____O2↑+____OH-。

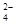 +____H2O — ____Fe(OH)3(胶体)+____O2↑+____OH-。
+____H2O — ____Fe(OH)3(胶体)+____O2↑+____OH-。