微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫、铁和镍的化合物。
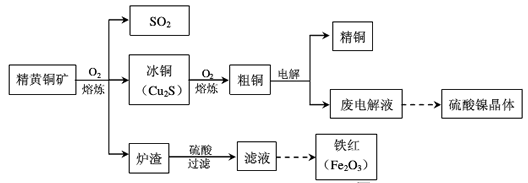
回答下列问题。
(1) Cu2S熔炼过程发生的主要反应为:
2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) △H=-768.2 kJ/mol
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g) △H=+116.0 kJ/mol
在熔炼过程中不需要持续加热,原因是____。
(2)熔炼过程中产生大量的___(填分子式),可进一步加工并作为上述流程中的原料加以循环利用。
(3)炉渣的主要成分是Fe2O3、FeO、Al2O3、SiO2,为了得到铁红,需对上述滤液进行处理,处理过程涉及下列步骤中的___(填序号)。
A.氧化 B.还原 C.灼烧 D.加碱
(4)废电解液中含有较多的Ni2+ ,从废电解液提取硫酸镍晶体,需要用电解法把电解液中的Cu2+ 除去,电解的阳极可以采用___作为电极材料,阳极的电极反应式是____。
(5)从废电解液中除去Pb2+的方法是往其中通入H2S至饱和,使Pb2+转化为硫化铅沉淀,溶液的 pH对转化效果的影响是____。已知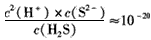 ,饱和H2S溶液中c( H2S)为0.1 mol/L,NiS的Ksp=10-11,若废 电解液的pH =5,为保证不生成NiS沉淀,Ni2+的浓度应控制在__以下。
,饱和H2S溶液中c( H2S)为0.1 mol/L,NiS的Ksp=10-11,若废 电解液的pH =5,为保证不生成NiS沉淀,Ni2+的浓度应控制在__以下。
参考答案:(1)Cu2S与O2反应的热化学方程式为:Cu2S(s)+O2(g)=2Cu(s)+SO2(g) △H= - 217.4kJ/mol,反应放出的热量足以维持反应的进行
(2) SO2
(3)ACD
(4)惰性电极 ;4OH--4e-=2H2O+O2↑(或Ni - 2e - =Ni2+)
(5)溶液的pH越大,转化效果越好 ;1 mol/L
本题解析:
本题难度:困难
2、填空题 铁氧体可用于隐形飞机上吸收雷达波涂料。一种以废旧锌锰电池为原料制备锰锌铁氧体的主要流程如下
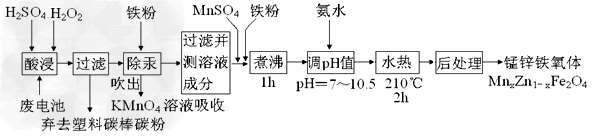
(1)酸浸时,二氧化锰被双氧水还原的化学方程式为___________________________
(2)活性铁粉除汞时,铁粉的作用是_____(填“氧化剂”或“还原剂”或“吸附剂”)
(3)除汞是以氮气为载气吹入滤液带出汞蒸汽经KMnO4溶液进行吸收而实现的。下图是KMnO4溶液处于不同pH值时对应的Hg去除率变化图,图中物质为Hg与MnO4-在该pH范围内的主要产物。
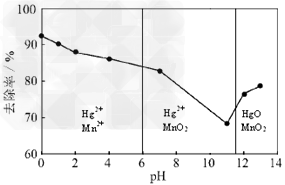
①请根据该图给出pH值对汞去除率影响的变化规律:_______________________。
②试猜想在强酸性环境下汞的去除率高的原因:_____________。
(4)当x=0.2时,所得到的锰锌铁氧体对雷达波的吸收能力特别强,试用氧化物形式表示该铁氧体组成____________________。
(5)经测定滤液成分后同时加入一定量的MnSO4和铁粉的目的是_____________________。
参考答案:(1)MnO2+H2O2+H2SO4 = MnSO4 +O2↑+2H2O
(2)还原剂
(3)①随pH值的升高汞的去除率先降低后增加;②Mn2+具有催化作用
(4)MnO·4ZnO·5Fe2O3
(5)调节滤液离子的成分,符合水热后获得锰锌铁氧化体组成
本题解析:
本题难度:一般
3、填空题 硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CuO等,生产工艺流程示意如下:
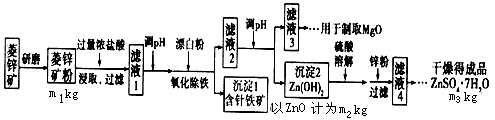
(1)将菱锌矿研磨成粉的目的是 ________________________ 。
(2)完成“氧化除铁”步骤中反应的离子方程式:
口Fe(OH)2+口________+口______=口Fe(OH)3+口Cl-
(3)针铁矿(Coethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O 和H,化学式量为89,化学式是________。
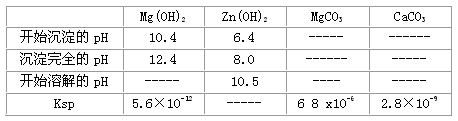
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为___________。
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是____(选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为____、____、过滤、洗涤、干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于_______。
参考答案:(1)增大反应物接触面积或增大反应速度或使反应更充分
(2)2;1;ClO-;1;H2O;2;1
(3)FeO(OH)(或其他合理答案)
(4)8.0≤pH<10.4(或其他合理答案)
(5)b(或b和d),d
(6)蒸发浓缩;冷却结晶(或其他合理答案)
(7)125m2/81m1(或其他合理答案)
本题解析:
本题难度:一般
4、选择题 某工业生产经过以下转化步骤:下列说法中不正确的是
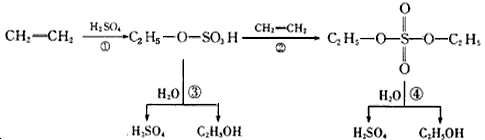
[? ]
A.该过程是一种新的硫酸生产方法
B.该过程中硫酸是催化剂
C.该过程中①、②是加成反应
D.该过程中③、④是酯类的水解反应
参考答案:A
本题解析:
本题难度:一般
5、填空题 明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,此外还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:?
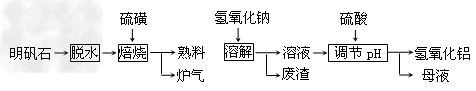
回答下列问题:
(1)“焙烧”过程中发生的反应为2Al2(SO4)3+3S 2Al2O3?+9SO2?,其中氧化剂为__________。 ?
2Al2O3?+9SO2?,其中氧化剂为__________。 ?
(2)“溶解”时反应的离子方程式为___________。 ?
(3)“调节pH”后过滤、洗涤Al(OH)3沉淀,证明已洗涤干净的实验操作和现象是?__________?。
(4)调节pH时使用的是质量浓度(单位体积溶液所含溶质的质量)为882?g/L?的H2SO4?,配制1L该溶液,需用量筒量取质量分数为98﹪的硫酸(密度是1.8g/cm3)__________mL
(5)“废渣”、“母液”中可回收的物质分别是______________。
参考答案:(1)Al2(SO4)3
(2)Al2O3+2OH-=2AlO2-+H2O?
(3)取最后一次洗涤的流出液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净。?
(4)500.0 mL
(5)Fe2O3 、K2SO4、Na2SO4
本题解析:
本题难度:一般