微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 氟碳铈矿主要化学成分为CeFCO3,它是提取铈族稀土元素的重要矿物原料。氟碳铈矿的冶炼处理工艺已经发展到十数种,其中一种提取铈的工艺流程如下
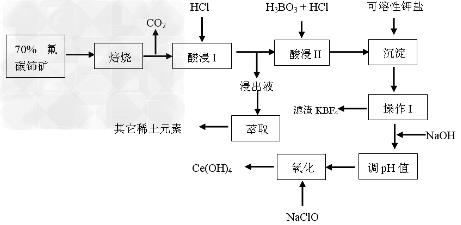
已知:焙烧后烧渣中含+4价的铈及+3价的其它稀土氟氧化物;酸浸I的浸出液中含少量的+3价的铈请回答下列问题
(1)焙烧前将矿石粉碎成细颗粒的目的是________________________________
(2)酸浸II后,四价铈转化为三价,为了避免三价铈以四氟硼酸盐形式损失,用可溶性钾盐将四氟硼酸根沉淀除去,该反应的离子方程式为_____________________________
(3)在生产过程中,酸浸I?中会产生大量黄绿色气体,污染环境、腐蚀设备,写出产生黄绿色气体的离子方程式:_________________________________提出一种解决的方案:__________________________________________________________
(4)实验室中进行操作I所用玻璃仪器名称:________________________________;在操作I后的溶液中加入NaOH溶液是为了调节溶液pH值获得Ce(OH)3,测定该溶液pH值的操作是________________________________
(5)写出氧化步骤的化学方程式:____________________, 其中还原产物是___________.
参考答案:(1)增大固体与空气的接触面积,增大反应速率;提高原料的利用率
(2)K+?+?BF4-?=?KBF4↓
(3)2Ce4+?+2Cl-?=?2Ce3+?+?Cl2↑;用H2SO4酸浸
(4)漏斗?烧杯?玻璃棒;撕下一小片pH试纸放在干燥洁净的表面皿上,用玻璃棒蘸取该溶液点在pH试纸的中央,然后与标准比色卡对比
(5)2Ce(OH)3?+?NaClO?+?H2O?=?2Ce(OH)4?+?NaCl;NaCl
本题解析:
本题难度:一般
2、填空题 MgSO4·7H2O可用于造纸、纺织、陶瓷、油漆工业,也可在医疗上用作泻盐。某工业废渣主要成分是MgCO3,另外还有CaCO3、SiO2等杂质。从此废渣中回收MgSO4·7H2O的工艺如下:
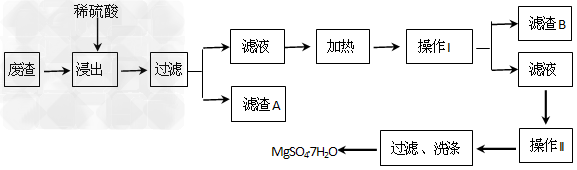
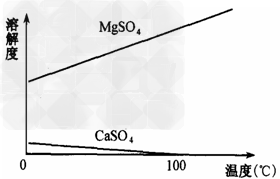
已知CaSO4和MgSO4的溶解度(S)随温度(T)变化曲线如图所示,试回答下列问题:
(1)“浸出”步骤中,通常保持硫酸过量,其目的是___________________
(2)滤渣B的主要成分的化学式是_____________,举出该物质在工业生产中的一个应用实例?________________________。
(3)操作I的名称是______________,操作II的名称是_______________。
(4)有人认为Mg2+易水解,经操作II后再过滤、洗涤得不到MgSO4·7H2O晶体,因此在后续过程中也需保持硫酸过量,你认为这种说法是否正确_______________________。(填“是”或“否”),原因是________________________。
参考答案:(1)提高镁的浸出率?
(2)CaSO4、制石膏或水泥
(3)趁热过滤;蒸发浓缩、冷却结晶
(4)否;硫酸是难挥发性酸
本题解析:
本题难度:一般
3、填空题 Li2MSiO4(M=Mn、Fe、Co等)是极具发展前景的新型锂离子电池的电极材料,下面列出了两种制备
Li2FeSiO4的方法。同相法:2Li2SiO3+FeSO4 Li2FeSiO4+Li2SO4+SiO2
Li2FeSiO4+Li2SO4+SiO2
溶胶一凝胶法: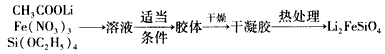
(1)固相法中制备Li2FeSiO4的过程必须在惰性气体氛围中进行,其原因是___________________。
(2)溶胶一凝胶法中,检验溶液中有胶体产生的方法是_________________实验中若制得1mol Li2FeSiO4,整个反应过程中转移电子的数目为__________。
(3)以Li2FeSiO4、嵌有Li的石墨为电极,含Li+的导电固体为电解质的锂离子电池,充、放电的总反应式可表示为Li2FeSiO4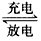 Li+LiFeSiO4,该电池放电时的正极反应式为____________________。
Li+LiFeSiO4,该电池放电时的正极反应式为____________________。
(4)Li2MSiO4的性能对比如下图所示。实际应用时,常用含有来源丰富的铁元素的Li2FeSiO4作电极材料,使用该电极材料的另一个优点是______________。
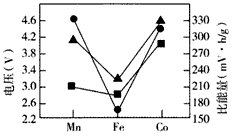
▲Li2MSiO4充电时脱去Li+所需电压 ●Li2MSiO4放电时的理论电压 ●Li2MSiO4放电时的理论比能量
参考答案:(1)防止+2价铁被氧化
(2)取少量液体,用一束强光照射,有丁达尔效应;NA(或6.02×1023)
(3)LiFeSiO4+Li++e-=Li2FeSiO4
(4)Li2FeSiO4充电时脱去Li+所需电压低
本题解析:
本题难度:一般
4、填空题 硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制 备高纯硅的主要方法,生产过程示意图如下:

①写出由纯SiHCl3,制备高纯硅的化学反应方程式________________________。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式______________________________;H2还原SiHCl3 过程中若混入O2,可能引起的后果是_________________________________。
(2)下列有关硅材料的说法正确的是____(填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料--光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅?
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。写出实验现象并给予解释________。
参考答案:(1)①SiHCl3+H2 Si+3HCl;②SiHCl3+3H2O= H2SiO3↓十3HCl↑+H2↑ 氧气与氢气混合,可能引起爆炸,氧气可能会氧化SiHCl3,
Si+3HCl;②SiHCl3+3H2O= H2SiO3↓十3HCl↑+H2↑ 氧气与氢气混合,可能引起爆炸,氧气可能会氧化SiHCl3,
(2)BC
(3)现象:试管中有白色胶状沉淀生成,并且有刺激性气体生成。
本题解析:
本题难度:一般
5、填空题 以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸钾和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:
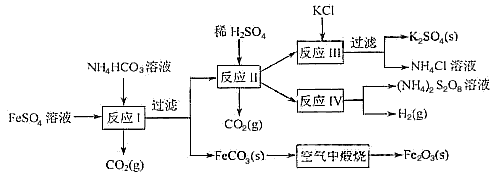
(1)反应Ⅰ前需在FeSO4溶液中加入_____(填字母),以除去溶液中的Fe3+
A.锌粉
B.铁屑
C.KI溶液
D.H2
(2)反应Ⅰ需控制反应温度低于35℃,其目的是_______________。
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是_________________。
(4)反应Ⅳ常被用于电解生产 (NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为________________。
参考答案:(1)B
(2)防止NH4HCO3分解(或减少Fe2+的水解)
(3)降低K2SO4的溶解度,有利于K2SO4析出
(4)2SO42--2e-=S2O82-
本题解析:
本题难度:一般