|
高考化学知识点归纳《化学平衡》考点预测(2017年强化版)(十)
2017-07-10 19:37:34
来源:91考试网
作者:www.91exam.org 【 大 中 小】
参考答案:C
本题解析:从图看出温度越高c(I3-)越小,则温度高平衡向逆向移动,说明逆向是吸热反应,正向就是放热反应,A对;状态D时还没有到达平衡所以V正> V逆 ,B对;状态A与状态B相比,状态A的c(I2)小,C错;反应是放热反应,温度越高平衡常数越小,D对,选C。
考点:化学平衡的移动和平衡常数。
本题难度:困难
2、填空题 (14分)煤炭气化可以提高燃料的利用率,又可以合成新型能源。
(1)煤炭气化时发生的反应为:C(s)+H2O(g) H2(g)+CO(g)。 H2(g)+CO(g)。
①已知:2C (s)+O2(g)=2CO (g);△H1=
参考答案:
本题解析:
本题难度:一般
3、选择题 有一处于平衡状态的反应A(g) + 3B(g)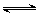 2C(g)△H<0,为了使平衡向生成 2C(g)△H<0,为了使平衡向生成 C的方向移动,应选择的条件是〔 〕 C的方向移动,应选择的条件是〔 〕
①升高温度 ②降低温度 ③ 增大压强 ④降低压强 ⑤加入催化剂 ⑥分离出C
A ①③⑤ B ②③⑤ C ②③⑥ D ②④⑥
参考答案:D
本题解析:略
本题难度:一般
4、填空题 常温下,两种溶液① 0.1 mol?L-1 NH3·H2O ② 0.1 mol?L-1 NH4Cl中:
(1)溶液①的pH 7(填“>”、“<”或“=”),其原因是: (用电离方程式表示)。
(2)溶液②呈 性(填“酸”、“碱”或“中”)。水解反应是吸热反应,升温可以 (填“促进”或“抑制”)NH4Cl的水解。
(3)下列关于两种溶液中c(NH4+) 的叙述正确的是 (填字母)。
a.两种溶液中c(NH4+) 都等于0.1 mol?L-1
b.两种溶液中c(NH4+) 都小于0.1 mol?L-1
c.NH4Cl溶液中c(NH4+) 小于NH3·H2O溶液中c(NH4+)
参考答案:(1)>(1分) NH3·H2O  NH4+ +OH- (2分) NH4+ +OH- (2分)
(2)酸(1分) 促进(1分)
(3)b (1分)
本题解析:
试题解析:(1)NH3·H2O是弱碱,其在水中部分电离产生NH4+、OH-,所以pH>7,
(2)NH4Cl溶液中的NH4+水解会使溶液呈酸性,pH<7,水解反应是吸热反应,升温使平衡向吸热反应方向进行,因此会促进NH4Cl的水解。
(3)a、NH3·H2O是弱碱,不完全电离;NH4Cl溶液中NH4+部分水解,所以两种溶液NH4+的浓度均小于0.1mol/l,错误;b、正确;c、两种溶液中NH4+的浓度的大小由电离程度和水解程度的强弱来判断,本题中无法判断,答案选b。
考点:考查溶液的酸碱性、弱电解质的电离、盐的水解、外界条件对平衡的影响
本题难度:一般
5、选择题 在一定温度下,可逆反应A(g)+3B(g)?2C(g)达到平衡状态的标志是( )
A.C生成的速率与A分解的速率相等
B.单位时间生成nmolA,同时生成3nmolB
C.A、B、C的浓度不再变化
D.A、B、C的分子数比为1:3:2
参考答案:A、对可逆反应X(g)+3Y(g)═2Z(g)来说,C生成的速率与A消耗的速率都只表示该反应的正反应速率,无法判断正反应速率与逆反应速率是否相等,故A错误.
B、无论反应是否达到平衡,这个关系总是成立的,反应方向一致,故B错误;
C、在一定条件下的可逆反应里,达到平衡状态时,反应混合物中各组成成分的浓度保持不变,故C正确;
D、达平衡时,A、B、C三种物质的分子数之比可能是1:3:2,也可能不是1:3:2,这要看反应开始时加入的A、B、C三种物质是否按1:3:2比例而定,故D错误.
故选C
本题解析:
本题难度:一般
|