微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (9分)A、B、C为三种常见的单质,其中A、C为气体,B为常见金属。A溶于水所得的溶液可使石蕊试液先变红后退色。F的水溶液为浅绿色溶液,它们的关系如图:
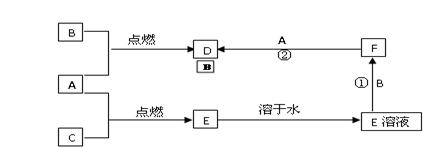
(1)写出A、B、D的化学式:A.??B.??D.?
(2) 写出反应①②的离子方程式
①?
②?
(3)检验D的水溶液中的阳离子的方法是:??。将D溶液逐滴加入沸水中会产生一种红褐色的澄清液体。有同学认为该液体中的分散质粒子直径应该在1nm~100nm之间,验证这一想法的简单方法是:?。
(4)如右图某同学将A的饱和溶液装满大试管倒置于烧杯中,光照一段时间后,发现试管底部有无色的气体产生,溶液 的颜色也变成无色,请你帮他对产生的气体进行探究:
的颜色也变成无色,请你帮他对产生的气体进行探究:
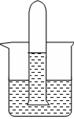
a.你预测气体可能是?。
b.针对你的预测写出验证实验方案:?。
参考答案:(9分)(1)Cl2? Fe? FeCl3?
(2)①Fe+2H+==Fe2++H2?②2Fe2++Cl2==2Fe3++2Cl―
(3)取少量溶液于试管中,滴加几滴KSCN溶液,若溶液变红色,则证明有Fe3+,若溶液不变红色,则证明没有Fe3+?是否有丁达尔现象?(或描述丁达尔现现象的操作)
(4)a、O2?b、在水下堵住试管口,取出正放,用带火星的木条伸入试管,若木条复燃,则说明是O2?(每空1分)
本题解析:略
本题难度:一般
2、推断题 物质A有如图所示转化关系,其中乙为金属单质,常温下,它在G的浓溶液中发生钝化,F的溶液中只含有一种溶质(有的反应可能在水溶液中进行,有的反应的生成物未全部给出,反应条件也未注明)。

请讨论以下两种情况(注:两种情况下各字母代表的物质可能不同):
(1)第一种情况:A为气体;用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近时,有大量白烟生成;甲为焰色反应呈黄色的金属单质;D和F的溶液均呈碱性。则:
①D与乙反应的离子方程式为___________________;
②用离子方程式表示F溶液显碱性的原因:_______________________。
(2)第二种情况:A是工业上常见的矿石,甲可由两种单质直接化合得到,D的水溶液加入HNO3酸化的AgNO3溶液有白色沉淀生成。则:
①工业上,反应I在__________(填设备名称)中进行;
②用电子式表示化合物甲的形成过程:_____________________;
③D和乙反应的离子方程式为__________________;
④反应Ⅱ的化学方程式为__________________。
参考答案:(1)①2Al+2OH-+2H2O=2AlO2-+3H2↑;②AlO2-+2H2O Al(OH)3+OH-
Al(OH)3+OH-
(2)①沸腾炉;②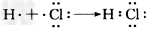 ;③2Fe3++Fe=3Fe2+; ④2SO2+O2
;③2Fe3++Fe=3Fe2+; ④2SO2+O2 2SO3
2SO3
本题解析:
本题难度:一般
3、选择题 (17分)A、B、C、D、E五种元素原子序数依次增大,除E外均为短周期主族元素,B、C、D同周期,A、D同主族。A的最外层有三个未成对的电子,B是同周期第一电离能最小的元素,C的原子结构示意图为:?,E的价层电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A _______? B_______? C _______? D _______
(2)用元素符号表示A、C、D电负性由小到大的顺序____________。
(3)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是_____。
(4) D的氢化物比A的氢化物的沸点_____(填"高"或"低"),A的氢化物分子立体构型为________。
(5) E元素在周期表的位置是______________。
(6) B、C、D最高价氧化物的晶体类型是分别是______、________、______。
参考答案:(1) N? Na ?Si?P?(2) Si<P<N?(3) HNO3?(4) 低,三角锥形?
(5)第四周期VIII族?(6)离子晶体、原子晶体、分子晶体
本题解析:考查元素原子的电子排布规律即元素周期表和元素周期律。
(1)C的原子结构示意图为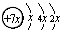 ,所以x=2,即C是硅元素。B、C、D同周期,A、D同主族,因此A是第二周期元素。A的最外层有三个未成对的电子,所以A是氮元素,则D是磷元素。金属性越强,电离能越小,所以B是第三周期的钠元素。根据E的价层电子排布式3d64s2并结合构造原理可得出E是铁元素。
,所以x=2,即C是硅元素。B、C、D同周期,A、D同主族,因此A是第二周期元素。A的最外层有三个未成对的电子,所以A是氮元素,则D是磷元素。金属性越强,电离能越小,所以B是第三周期的钠元素。根据E的价层电子排布式3d64s2并结合构造原理可得出E是铁元素。
(2)非金属性越强,电负性越大,非金属性是Si<P<N,则电负性也Si<P<N。
(3)非金属性越强,最高价氧化物对应水化物的酸性越强。
(4)氨气中存在氢键,所以其沸点高于PH3的。
(5)铁属于第四周期第VIII族。
(6)B、C、D最高价氧化物分别是Na2O、SiO2、P2O5,其晶体类型分别是离子晶体、原子晶体、分子晶体。
本题难度:一般
4、填空题 A、B、C、D、E五种微粒具有相同的电子数,它们之间能发生如下反应:A+B=C+D;如果将B、D、E?混合B少量则有白色沉淀,B过量则无沉淀,请回答:
(1)用化学符号表示下列4种微粒:A:______B:______C:______D:______
(2)写出B、D、E?混合B过量时的离子方程式:______.
参考答案:A、B、C、D、E五种微粒具有相同的电子数,可以从10电子微粒来分析判断,10电子微粒:
一核:Ne、N3-、O2-、F-、Na+、Mg2+、Al3+
二核:HF、OH-
三核:H2O、NH2-
四核:NH3、H3O+
五核:CH4、NH4+
它们之间能发生如下反应:A+B=C+D;推断A为NH4+,B为OH-,C为NH3,D为H2O,如果将B、D、E 混合B少量则有白色沉淀,B过量则无沉淀,说明沉淀溶解在B(OH-)中,推断E为Al3+;
(1)化学符号表示下列4种微粒为:A为NH4+,B为OH-,C为NH3,D为H2O;故答案为:NH4+,OH-,NH3,H2O;
(2)B、D、E 混合B过量时的离子方程式为:Al3++4OH-═AlO-+2H2O;故答案为:Al3++4OH-═AlO-+2H2O;
本题解析:
本题难度:一般
5、简答题 下列物质之间能够发生如图所示的化学反应,框图中的“合金”由两种金属组成;取C溶液进行焰色反应其火焰呈黄色.在反应中产生的水均未在图中标出.请回答:

(1)写出下列物质的化学式:M:______、E:______
(2)写出下列反应的化学方程式:G→H:______
(3)写出下列反应的离子方程式:A→B+C:______;K→D:______.
参考答案:框图中的“合金”由两种金属组成;结合H为红褐色沉淀,则H为Fe(OH)3,合金与C反应而分离,且加酸生成沉淀K,则K为Al(OH)3,即合金中含有Al、Fe,取C溶液进行焰色反应其火焰呈黄色,含有Na元素,则A为Na,B为H2,D为NaAlO2,L为AlCl3,M为Al2O3,固体E为Fe,F为FeCl2,G为Fe(OH)2,
(1)由上述分析可知,M为Al2O3,E为Fe,故答案为:Al2O3;Fe;
(2)G→H为氢氧化亚铁转化为氢氧化铁,该反应为4Fe(OH)2+O2+2H2O=4?Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4?Fe(OH)3;
(3)A→B+C为钠与水的反应,离子反应为2Na+2H2O=2Na++2OH-+H2↑,K→D为氢氧化铝与碱反应生成偏铝酸钠的反应,该离子反应为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;Al(OH)3+OH-=AlO2-+2H2O.
本题解析:
本题难度:一般