微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)W固体受热分解为三种产物,其产物之间又能发生反应的转化关系如下图所示,试推断并回答填空:
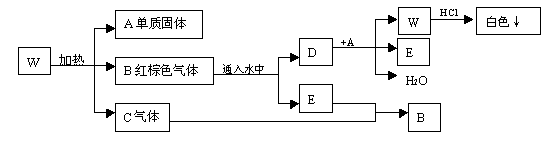
(1)写出下列物质的化学式:A________________? E____________
(2)写出W受热分解反应的化学方程式:_______________________________________
(3)写出D + A → W + E + H2O反应的离子方程式:?
参考答案:(8分)
⑴Ag? NO
⑵2AgNO3 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑
⑶3Ag+ NO3—?+ 4H+ = 3Ag+ + NO↑ + 2H2O
本题解析:略
本题难度:简单
2、填空题 (15分)下图中所有物质均为中学化学常见物质,F、H是气体单质,Z是金属单质,Y中阳离子与阴离子个数比为2 :1,化合物X、Y、A、D、E、G的焰色反应均为黄色,I是白色胶状沉淀。

请回答下列问题:
(1)Y的电子式??。关于Y的说法正确的是?。
A.Y是酸性氧化物? B. Y是过氧化物? C. Y是碱性氧化物? D. Y可以作漂白剂
(2)J溶液中离子浓度由大到小的顺序为_____________________________________________。
(3)写出G与盐酸反应生成I的离子方程式?。
(4)写出B与Y反应的化学方程式?。
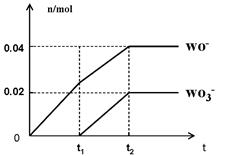
(5)将一定量的黄绿色气体W2通入到E的溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含W元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化如图所示。该反应中转移电子的物质的量是?mol,该反应总反应的化学方程式为
?。
参考答案:(1)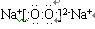 (2分)? B D (2分,错选项倒扣分,每个1分)
(2分)? B D (2分,错选项倒扣分,每个1分)
(2)C(Cl-)>C(Al3+)>C(H+)>C(OH-)(2分)
(3)AlO2- + H+ + H2O = Al(OH)3↓?(2分)
(4)Na2O2 + +SO2?= Na2SO4?(2分)
(5)0.14(2分)? 5Cl2 + 10NaOH =" 7NaCl" +2NaClO + 5H2O + NaClO3(3分,条件加热1分)
本题解析:略
本题难度:一般
3、填空题 各物质有如图所示的转化关系,已知:
(1)化合物E与水反应生成白色浆状物
(2)化合物F是不成盐的氧化物?
(3)组成D的元素在化合物中只能显负一价
据此请填空
(1)化合物F是______
(2)化合物I是______
(3)反应(2)的化学方程式是______
(4)反应(4)的化学方程式是______.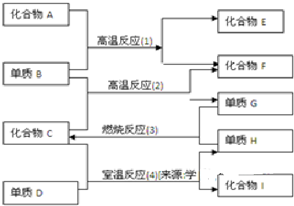
参考答案:反应(1)为高温下的反应,且化合物F为不成盐氧化物,则F为CO,B为C,则A为CaO或氧化铝,化合物E为CaC2或碳化铝;反应(2)为C与水蒸气的反应,所以C为水,G为H2,H为O2,单质D能置换出氧气,其氧化性比氧气的强,则D为F2,所以化合物I为HF,
(1)由上述分析可知,F为CO,故答案为:CO;
(2)由反应(4)的分析可知,I为HF,故答案为:HF;
(3)反应(2)的化学方程式为C+H2O(g)?高温?.?H2+CO,故答案为:C+H2O(g)?高温?.?H2+CO;
(4)反应(4)的化学方程式为2H2O+2F2═4HF+O2,故答案为:2H2O+2F2═4HF+O2.
本题解析:
本题难度:一般
4、填空题 某些化学反应可用下式表示:A+B→C+D+H2O
请回答下列问题(反应可以是固体之间的反应,也可以是在水溶液中进行的反应):
(1)若A是非金属气态单质,反应后所得溶液常用于消毒、杀菌。则A为?(填化学式下同)。反应的化学方程式为?。
(2)若A为非金属固态单质,C、D均为气体且都能使澄清石灰水变浑浊。则A为?。反应的化学方程式为?。
(3)若A为紫红色金属,D为有色气体。则A为?。反应的离子方程式为?。
(4)若A为烧碱溶液,C是相对分子质量为100的白色沉淀,D为正盐。则C为?。反应的离子方程式为?。
(5)若A、B为固体,C的水溶液能使酚酞溶液变为红色。实验室常用此反应制备C气体。则C为?。反应的化学方程式为?。
参考答案:(1)Cl2;2NaOH+Cl2=NaCl+NaClO+H2O
(2)C;C+2H2SO4(浓) CO2↑+2SO2↑+2H2O (3)Cu;Cu+4H++2NO3-=Cu2++2H2O+2NO2↑
CO2↑+2SO2↑+2H2O (3)Cu;Cu+4H++2NO3-=Cu2++2H2O+2NO2↑
(4)CaCO3;2OH-+Ca2++2HCO3-=2H2O+CaCO3↓+CO32-
(5)NH3;Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O↑(水的气体箭头不作要求)
CaCl2+2NH3↑+2H2O↑(水的气体箭头不作要求)
本题解析:(1)若A是非金属气态单质,反应后所得溶液常用于消毒、杀菌。则A为Cl2。B是氢氧化钠,则该反应的化学方程式为2NaOH+Cl2=NaCl+NaClO+H2O。
(2)若A为非金属固态单质,C、D均为气体且都能使澄清石灰水变浑浊,则气体应该是CO2和SO2,所以A为C,B是浓硫酸,该反应的化学方程式为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。
(3)若A为紫红色金属,则A是Cu;D为有色气体,则D可能是NO2,因此该是浓硝酸与铜发生的氧化还原反应,所以该反应的离子方程式为Cu+4H++2NO3-=Cu2++2H2O+2NO2↑。
(4)若A为烧碱溶液,C是相对分子质量为100的白色沉淀,则C是碳酸钙,化学式为CaCO3。D为正盐,则D为碳酸盐,B就是碳酸氢钠盐,所以该反应的离子方程式为2OH-+Ca2++2HCO3-=2H2O+CaCO3↓+CO32-。
(5)若A、B为固体,C的水溶液能使酚酞溶液变为红色,说明C溶液显碱性。实验室常用此反应制备C气体,则C为NH3。因此该反应的化学方程式为Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。
本题难度:一般
5、填空题 (8分)现有A、B、C、D、E五种强电解质,他们在水中可电离产生下列离子(每种电解质电离时只产生一种阳离子,而且不重复)。
阳离子
| H+、Na+、Al3+、Ag+、 Ba2+
|
阴离子
| OH-、 Cl-、CO32-、NO3-、SO42-
|
已知:①A、B两溶液呈碱性; C、D、E溶液呈酸性。
②向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失。
③D溶液与另外四种溶液反应都能产生沉淀。
试回答下列问题:
(1)A溶液呈碱性的原因是(用离子方程式表示)??;
(2)写出E溶液与过量B溶液反应的离子方程式??;
(3)若25℃时C、E溶液PH=4,则E溶液中水电离出的氢离子浓度是C溶液中水电离出的氢离子浓度的?倍;
(4)将C溶液逐滴加入等体积、等物质的量浓度的A溶液中反应后溶液中的一价(+1和-1)离子浓度由大到小的顺序为?。
参考答案:(每空2分,共8分) ⑴ CO32-+H2O  HCO3-+ OH-?
HCO3-+ OH-?
⑵ 2 Al3+ +3 SO42-+3 Ba2+ +8 OH-=3 Ba SO4↓+2AlO2-+4H2O?
⑶ 106 ?(4) c(Na+)>c(Cl-) >c(HCO3-) >c(OH-) >c(H+)
本题解析:略
本题难度:一般