微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 一水草酸钙(CaC2O4·H2O)可用作分离稀有金属的载体。其制备方法如下:
步骤I:用精制氯化钙稀溶液与草酸溶液共热反应,过滤,将固体溶于热盐酸中。
步骤Ⅱ:加氨水反应得一水草酸钙沉淀,过滤,热水洗涤,在105℃干燥得产品。
(1)写出步骤Ⅱ发生反应的化学方程式 。
(2)已知CaC2O4·H2O的Ksp = 2.34×10-9,为使步骤Ⅱ溶液中c(C2O42-)≤1×10-5 mol·L-1,c(Ca2+)的范围为 。
(3)为研究一水草酸钙的热分解性质,进行如下实验:准确称取36.50g样品加热,样品的固体残留率( )随温度的变化如下图所示。
)随温度的变化如下图所示。

①300℃时残留固体的成分为 ,900℃时残留固体的成分为 。
②通过计算求出500℃时固体的成分及质量。(写出计算过程)
参考答案:(1)H2C2O4+CaCl2+2NH3?H2O=CaC2O4?H2O↓+2NH4Cl+H2O;(2)≥2.34×10-4mol/L;
(3)①CaC2O4;CaO;②500℃时残留固体的成分为CaC2O4和CaCO3的混合物;样品中CaC2O4?H2O的物质的量为n(CaC2O4?H2O)="36." 50g/146g/ mol=0.25mol;设混合物中CaC2O4和CaCO3的的物质的量分别是xmol和ymol,根据500℃时固体总质量,可得128x+100y="36." 50g×76.16%;根据Ca元素守恒,可得x+y=0.25.解放出组可得x=0.1,y="0.15" 。m(CaC2O4)=0.1mol×128g/mol=12.8g;m(CaCO3)= 0.15mol×100g/mol=15.0g。
本题解析:在步骤I得到精制H2C2O4和CaCl2,然后向该溶液中加入浓氨水发生反应产生一水合草酸钙。发生该反应的方程式是:H2C2O4+CaCl2+2NH3?H2O=CaC2O4?H2O↓+2NH4Cl+H2O;(2)由于CaC2O4·H2O的Ksp = c(C2O42-)×c(Ca2+)=2.34×10-9,所以为使步骤Ⅱ溶液中c(C2O42-)≤1×10-5 mol·L-1,c(C2O42-)×c(Ca2+)≥2.34×10-9,
(Ca2+)>2.34×10-9÷1×10-5 mol/L =2.34×10-4mol/L。即c(Ca2+)的范围为≥2.34×10-4mol/mol;(3)CaC2O4·H2O 可能发生的分解反应是:CaC2O4·H2O CaC2O4·H2O,146g CaC2O4·H2O完全分解产生128g CaC2O4, 样品的固体残留率是(128g÷146g)×100%=87.67%,所以在300℃时残留固体的成分为CaC2O4;CaC2O4·H2O
CaC2O4·H2O,146g CaC2O4·H2O完全分解产生128g CaC2O4, 样品的固体残留率是(128g÷146g)×100%=87.67%,所以在300℃时残留固体的成分为CaC2O4;CaC2O4·H2O CaCO3+CO↑+ H2O, 样品的固体残留率是(100g÷146g)×100%=68.49%, CaC2O4·H2O
CaCO3+CO↑+ H2O, 样品的固体残留率是(100g÷146g)×100%=68.49%, CaC2O4·H2O CaO+CO2↑+CO↑+H2O。(56g÷146g) ×100%=38.36%,所以在900℃时残留固体的成分为CaO;由于在500℃时固体残留率是87.67%,>76.16%>68.49%;所以固体中应该含有的CaC2O4和CaCO3。样品中CaC2O4?H2O的物质的量为n(CaC2O4?H2O)="36." 50g/146g/ mol=0.25mol;设混合物中CaC2O4和CaCO3的的物质的量分别是xmol和ymol,根据500℃时固体总质量,可得128x+100y="36." 50g×76.16%;根据Ca元素守恒,可得x+y=0.25.解放出组可得x=0.1,y="0.15" 。m(CaC2O4)=0.1mol×128g/mol=12.8g;m(CaCO3)= 0.15mol×100g/mol=15.0g。
CaO+CO2↑+CO↑+H2O。(56g÷146g) ×100%=38.36%,所以在900℃时残留固体的成分为CaO;由于在500℃时固体残留率是87.67%,>76.16%>68.49%;所以固体中应该含有的CaC2O4和CaCO3。样品中CaC2O4?H2O的物质的量为n(CaC2O4?H2O)="36." 50g/146g/ mol=0.25mol;设混合物中CaC2O4和CaCO3的的物质的量分别是xmol和ymol,根据500℃时固体总质量,可得128x+100y="36." 50g×76.16%;根据Ca元素守恒,可得x+y=0.25.解放出组可得x=0.1,y="0.15" 。m(CaC2O4)=0.1mol×128g/mol=12.8g;m(CaCO3)= 0.15mol×100g/mol=15.0g。
考点:考查温度对物质分解产物成分的影响、溶度积常数的应用、物质化学性质的方程式表示、混合物中各组分含量的计算的知识。
本题难度:困难
2、选择题 向用盐酸酸化的MgCl2、FeCl3混合溶液中逐滴滴入NaOH溶液,生成的沉淀质量与滴入NaOH溶液体积关系如下图,则原混合溶液中MgCl2与FeCl3的物质的量之比为

A.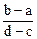
B.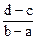
C.
D.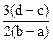
参考答案:D
本题解析:略
本题难度:简单
3、选择题 下表是五种银盐的溶度积常数(25℃)。下列说法错误的是

[? ]
A.五种物质在常温下溶解度最小的是Ag2S
B.向AgCl悬浊液中加入Na2S,则可以生成黑色沉淀
C.氯化银、溴化银和碘化银三种物质在常温下的溶解度依次增大
D.难溶电解质的溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
参考答案:C
本题解析:
本题难度:一般
4、选择题 下列说法正确的是( )
A.两难溶电解质作比较时,Ksp小的,溶解度一定小
B.欲使溶液中某离子沉淀完全,加入的沉淀剂应该是越多越好
C.所谓沉淀完全就是用沉淀剂将溶液中某一离子除净
D.欲使Ca2+离子沉淀最完全,选择Na2CO3作沉淀剂效果比Na2SO4好
参考答案:A.只有具有相同结构的难溶物(如AgCl、AgBr、AgI)Ksp小的溶解度小,而不同结构的(如Ag2SO4和AgI)Ksp小的溶解度不一定小,故A错误;
B.独考虑同离子效应,从理论上说,沉淀剂加入越多,被沉淀离子就越完全,但还存在另外两个效应:盐效应和配位效应,这两种效应都会促进沉淀溶解,尤其是配位效应,甚至会使沉淀完全溶解,所以沉淀剂的量并不是加得越多越好,而是适当过量就可以了,故B错误;
C.难溶电解质在溶液中存在溶解平衡,不可能加入沉淀剂将溶液中某一离子除净,故C错误;
D.碳酸钙的溶解度比硫酸钙小,则欲使Ca2+离子沉淀最完全,选择Na2CO3作沉淀剂效果比Na2SO4好,故D正确.
故选D.
本题解析:
本题难度:简单
5、选择题 把Ca(OH)2放入蒸馏水中,一段时间后达到如下平衡: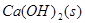

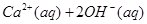 , 下列说法不正确的是
, 下列说法不正确的是
A.恒温下向溶液中加CaO,溶液的pH不变
B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中固体质量不变
D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量增加