|
高考化学必考知识点《化学平衡》试题预测(2017年最新版)(四)
2017-07-10 19:49:00
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在不同温度下(T1 <T2),可逆反应2X(g) 2Y(g)+Z(g) ΔH<0中,生成物Z在反应平衡混合物中的体积分数( 2Y(g)+Z(g) ΔH<0中,生成物Z在反应平衡混合物中的体积分数(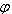 )与反应时间(t)的关系有以下图示,正确的是 )与反应时间(t)的关系有以下图示,正确的是
[? ]
A.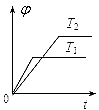
B.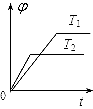
C.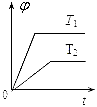
D.
参考答案:B
本题解析:
本题难度:一般
2、选择题 一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示。下列描述正确的是
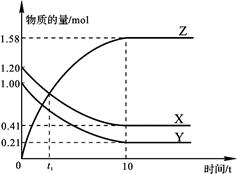
A.反应开始到10 s,用Z表示的反应速率为0.158 mol/(L·s)
B.反应开始到10 s时,Y的转化率为79.0%
C.t1时,Z和X的浓度相等,达到了化学平衡状态
D.反应的化学方程式为:X(g)+Y(g) Z(g) Z(g)
|
参考答案:B
本题解析:A、10s内,用Z表示的反应速率为v(Z)=1.58mol÷2L÷10s=0.079moL/(L?s),错误;B、反应开始到10 s时,Y消耗物质的量1.0mol-0.21mol=0.79mol,Y的转化率=0.79mol÷1.0mol×100%=79.0%,正确;C、t1时,Z和X的浓度相等,在t1时刻之后,X的物质的量进行减小,Z的物质的量进行增大,反应向正反应进行,反应未达到了化学平衡状态,错误;D、由图象可以看出,由图表可知,随反应进行X、Y的物质的量减小,Z的物质的量增大,所以X、Y是反应物,Z是生产物,l0s后X、Y、Z的物质的量为定值,不为0,反应是可逆反应,且△n(X):△n(Y):△n(Z)=(1.20-0.41)mol:(1.00-0.21)mol:1.58mol=1:1:2,参加反应的物质的物质的量之比等于化学计量数之比,故反应化学方程式为X(g)+Y(g)?2Z(g),错误。
考点:本题考查图像的分析、化学反应速率、化学平衡。
本题难度:一般
3、填空题 在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表 2NO2(g)体系中,n(NO)随时间的变化如表 : :
时间(s)
| 0
| 1
| 2
| 3
| 4
| 5
| n(NO)(mol)
| 0.020
| 0.011
| 0.008
| 0.007
| 0.007
| 0.007
|
(1)写出该反应的平衡常数表达式:K= 。
(2)如图中表示NO2的变化的曲线是 。用O2表示从0~2s内该反应的平均速率v=
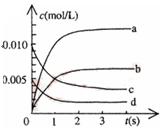
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆 (NO)=2v正(O2) d.容器内密度保持不变
(4)某同学查阅资料得知,该反应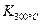 > >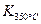 ;25 ℃时,生成1 mol NO2,热量变化为56.4 kJ。但是该同学由于疏忽,忘记注明“+”、“-”。根据题目信息,该反应的热化学方程式为 。 ;25 ℃时,生成1 mol NO2,热量变化为56.4 kJ。但是该同学由于疏忽,忘记注明“+”、“-”。根据题目信息,该反应的热化学方程式为 。
(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
参考答案:(12分)(1)K=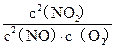 (2)b 1.5×10-3mol·L-1·s-1 (3)b c (2)b 1.5×10-3mol·L-1·s-1 (3)b c
(4) 2NO(g)+O2(g)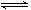 2NO2(g) ΔH=" -112.8" kJ (5)c 2NO2(g) ΔH=" -112.8" kJ (5)c
本题解析:略
本题难度:一般
4、填空题 (18分)
Ⅰ.在一定条件下,xA+yB 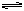 zC,达到平衡,试填写下列空白: zC,达到平衡,试填写下列空白:
(1)已知C是气体,且x+y=z,加压时平衡如果发生移动,则平衡必向___ ___移动。
(2)若B、C是气体,其他条件不变时增加A的用量,平衡不移动,则A的状态为___ ___。
Ⅱ.已知NO2和N2O4可以相互转化:
2NO2(g) 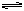 N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。 N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。

(1)图中共有两条曲线X和Y,其中曲线_______表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是__________。
(2)①前10 min内用NO2表示的化学反应速率v(NO2)=_______mol·L-1·min-1。
②0~15 min ,反应2NO2(g) 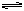 N2O4(g)的平衡常数Kb=_______。 N2O4(g)的平衡常数Kb=_______。
③25 min~35 min时,反应2NO2(g) 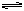 N2O4(g)的平衡常数Kd_____Kb(填“>”、 “=”或“<”)。 N2O4(g)的平衡常数Kd_____Kb(填“>”、 “=”或“<”)。
(3)反应25 min时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是___________________(用文字表达),若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25 min时还可以采取的措施是_________。
A.加入催化剂 B.缩小容器体积 C.升高温度 D.加入一定量的N2O4
参考答案:Ⅰ. (1)逆反应方向(左) ;(2)固体或纯液体;Ⅱ.(1)X b和d ;(2)①0.04 ②10/9 ③=;(3)增大NO2的浓度 B、D
本题解析:Ⅰ. (1)加压若平衡移动,则反应前后气体体积发生变化,即A、B可能有一种是非气体,加压平衡向逆向移动,答案为:逆反应方向;(2)B、C为气体,增加A的用量,平衡不移动,说明A为固体或纯液体,答案为:固体或纯液体;Ⅱ.(1)二氧化氮的浓度变化是四氧化二氮的两倍,故X曲线表示二氧化氮的浓度变化;平衡时浓度保持不变,故b和d表示达到平衡状态,故答案为)X b和d ;(2)①10min中内二氧化氮的浓度由0.6mol/L变化到0.2mol/L,故速率为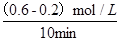 =0.04mol·L-1·min-1。②Kb= =0.04mol·L-1·min-1。②Kb=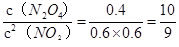 ;③25min时增大二氧化氮的浓度,平衡常数只受温度影响,故Kd=Kb;(3)25min时二氧化氮的浓度瞬时增大,四氧化二氮的浓度在此时刻不变,故应该是增大NO2的浓度,故答案为:增大二氧化氮的浓度; B、D. ;③25min时增大二氧化氮的浓度,平衡常数只受温度影响,故Kd=Kb;(3)25min时二氧化氮的浓度瞬时增大,四氧化二氮的浓度在此时刻不变,故应该是增大NO2的浓度,故答案为:增大二氧化氮的浓度; B、D.
考点:化学平衡移动
本题难度:一般
5、填空题 (10分)某课外活动小组为了探究温度对化学平衡的影响,做了如下实验:
该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体。已知2NO2(g) N2O4(g) ΔH(298K)=-52.7kJ·mol-1。 N2O4(g) ΔH(298K)=-52.7kJ·mol-1。
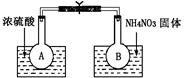
请回答:
(1)A中的现象 ,B中的现象 ;
(2)由此可知,降低温度,该化学平衡向 (填“正”或“逆”)反应方向移动;
(3)该化学反应的浓度平衡常数表达式为 ,升高温度,该反应中NO2的转化率将 (填“增大”、“减小”或“不变”)。
参考答案:(1)气体颜色加深 气体颜色变浅 (2)正 (3)Kc = 减小
本题解析:(1)根据反应2NO2(g) N2O4(g) ΔH(298K)=-52.7kJ·mol-1,A中相当于加热,所以平衡逆向移动,气体颜色加深,B中相当于降温,所以平衡正向移动,气体颜色变浅。 N2O4(g) ΔH(298K)=-52.7kJ·mol-1,A中相当于加热,所以平衡逆向移动,气体颜色加深,B中相当于降温,所以平衡正向移动,气体颜色变浅。
(2)降温平衡正向移动。
(3)根据反应2NO2(g) N2O4(g)得K=,升高温度,平衡逆向移动,NO2的转化率减小。 N2O4(g)得K=,升高温度,平衡逆向移动,NO2的转化率减小。
考点:化学平衡移动
点评:本题非常基础简单,主要考查化学平衡的基础知识。
本题难度:一般
| 
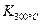 >
>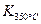 ;25 ℃时,生成1 mol NO2,热量变化为56.4 kJ。但是该同学由于疏忽,忘记注明“+”、“-”。根据题目信息,该反应的热化学方程式为 。
;25 ℃时,生成1 mol NO2,热量变化为56.4 kJ。但是该同学由于疏忽,忘记注明“+”、“-”。根据题目信息,该反应的热化学方程式为 。