微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 N0代表阿伏伽德罗常数的值。已知C3H6和C6H12的混合物的质量为m g,则该混合物?
A.所含共用电子对数目为 3m N0/14
B.所含原子总数为m N0 /14
C.燃烧时消耗的O2一定是33.6m/14 L
D.所含碳氢键数目为m N0/7
参考答案:AD
本题解析:C3H6和C6H12的最简式为CH2,所以mg混合物中含有最简式CH2的物质的量为m/14 mol。在环烷烃、烯烃分子中,每个C含有1个碳碳共用电子对、每个H形成了1个碳氢共用电子对,所以总共含有3m/14mol共用电子对,A正确;所含原子总数为m/14 mol×3×No,B错误;未说明O2的状态,无法确定气体体积,C错误;每个氢原子形成1个碳氢键,ag混合物中总共含有m/7 molH原子,所以含有m/7 molH原子碳氢键,所含碳氢键数目为m N0/7,D正确。
本题难度:一般
2、选择题 与50mL0.1mol/LNa2CO3溶液中Na+的物质量浓度相同的溶液是( )
A.50mL0.1mol/L的NaCl溶液
B.25mL0.2mol/L的Na2SO4溶液
C.100mL0.2mol/L的NaNO3溶液
D.10mL0.5mol/L的Na2CO3溶液
参考答案:50mL0.1mol/LNa2CO3溶液中Na+的物质量浓度为:0.1mol/L×2=0.2mol?L-1,
A、50mL0.1mol/L的NaCl溶液中Na+的物质量浓度为:0.1mol/L×1=0.1mol?L-1,故A错误;
B、25mL0.2mol/L的Na2SO4溶液中Na+的物质量浓度为:0.2mol/L×2=0.4mol?L-1,故B错误;
C、100mL0.2mol/L的NaNO3溶液中Na+的物质量浓度为:0.2mol/L×1=0.2mol?L-1,故C正确;
D、10mL0.5mol/L的Na2CO3溶液中Na+的物质量浓度为:0.5mol/L×2=1mol?L-1,故D错误;
故选:C.
本题解析:
本题难度:简单
3、选择题 下列说法正确的是(NA表示阿伏加德罗常数)
A.15g甲基中含有的电子数为10NA
B.标准状况下,以任意比例混合的甲烷和丙烷混合物22.4L,所含有的分子数为NA
C.标准状况下的22.4L辛烷完全燃烧,生成二氧化碳分子数为8NA
D.在1L 1mol/L 的盐酸溶液中,所含氯化氢分子数为NA
参考答案:B
本题解析:略
本题难度:简单
4、填空题 (10分)(1)含10.8gAl3+的Al2(SO4)3中所含的SO42-的物质的量是 。
(2)已知16g A与20g B恰好完全反应生成0.04 mol C和31.76g D,则C的摩尔质量为 。
(3)0.1 mol Na中含 mol e-,在跟足量水反应中失去 mol e-。
(4)标准状况下V L氨气溶解在1L水中,所得溶液的密度为ρg/mL,质量分数为ω,物质的量浓度为c mol/L,则ω= 。
参考答案:(10分,无单位不给分)
(1)0.6 mol (2)106 g/mol (3)1.1 0.1
(4)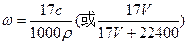
本题解析:略
本题难度:一般
5、简答题 (1)在MgCl2、NaCl、Na2SO4三种盐的混合溶液1L,若Na+为3mol、Cl-为3.8mol、Mg2+为1.5mol,则Na2SO4的物质的量浓度为______mol/L.
(2)在标准状况下,100ml某气体X的质量是0.179克,则这种气体X的相对分子质量是______.
(3)铁钉在氯气中被锈蚀为棕黄色物质FeCl3,而在盐酸中生成浅绿色的FeCl2溶液.则在Cl2、Cl-、H+中,氧化性最强的是______.
(4)有X、Y、Z三种元素,已知:①X、Y、Z的单质在常温下均为气体;②每2个X2分子可与1个Y2分子化合生成2个X2Y分子,X2Y在常温下为液体;③Z单质溶于X2Y中,所得溶液具有漂白作用;④Z单质可以与石灰乳反应制漂白粉.
①写出元素Z的名称:______.②写出④的化学反应方程式为:______.
参考答案:(1)根据电荷守恒n(Na+)+2n(Mg2+)=n(Cl-)+2n(SO42-),即3mol+1.5mol×2=3.8mol+2n(SO42-),解得n(SO42-)=1.1mol,由硫酸根守恒可知n(Na2SO4)=n(SO42-)=1.1mol,故Na2SO4的物质的量浓度为1.1mol1L=1.1mol/L,故答案为:1.1;
(2)标准状况下,100ml某气体X的物质的量为0.1mol22.4L/mol=0.122.4mol,其质量是0.179克,故X的摩尔质量为0.179g0.122.4mol=40g/mol,故相对分子质量为40,故答案为:40;
(3)铁钉在氯气中被锈蚀为棕黄色物质FeCl3,而在盐酸中生成浅绿色的FeCl2溶液,同一还原剂与不同氧化剂反应,生成物的价态越高,氧化剂的氧化性越强,故氧化性Cl2>H+中,Cl-处于最低价态,没有氧化性,故氧化性最强的为,故答案为:Cl2;
(4)X、Y、Z三种元素,X、Y、Z的单质在常温下均为气体;Z单质可以与石灰乳反应制漂白粉,Z为Cl元素,X2Y在常温下为液体,Z单质溶于X2Y中,所得溶液具有漂白作用,X2Y为H2O,故X为H元素,Y为O元素,验证符合,
①由上述分析可知,元素Z的名称为氯,故答案为:氯;
②氯气与氢氧化钙反应生成氯化钙、次氯酸根与水,反应方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
本题解析:
本题难度:简单