| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《离子方程式的书写及正误判断》试题特训(2017年最新版)(四)
参考答案:C 本题解析:略 本题难度:一般 2、选择题 下列离子方程式中,错误的是( ) |
参考答案:C
本题解析:A.反应符合事实,拆写无误,正确; B.将氨通入盐酸溶液中:NH3+H+= NH4+反应符合事实,拆写无误,正确;C.在漂白粉溶液中通入SO2由于产生的HClO有强氧化性,会把CaSO3氧化为CaSO4,离子方程式是:Ca2++ClO-+ SO2+H2O = CaSO4↓+Cl-。错误;D.反应符合事实,拆写符合离子方程式的原子,正确。
考点:考查离子方程式书写的正误判断的知识。
本题难度:一般
3、填空题 按图的装置连接好仪器,先在烧杯中加入20mL左右的Ba(OH)2溶液,接通电源后,逐渐滴加稀硫酸至过量。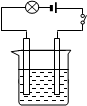
(1)当逐渐滴加稀硫酸时,烧杯中观察到的现象是: 。
(2)灯泡的现象是: ;原因是: 。
(3)发生反应的离子方程式为:
参考答案:(1)生成白色沉淀
(2)先变暗后变亮 Ba(OH)2和H2SO4先发生反应使离子浓度减小,然后H2SO4过量离子浓度增大
(3)Ba2++SO42-+ 2OH-+2H+= BaSO4↓+2H2O
本题解析:向Ba(OH)2溶液中,逐滴加入稀硫酸,先生成BaSO4沉淀,溶液的导电性减弱,所以灯泡先变暗;稀硫酸过量时,溶液中H+和SO42-浓度增大,灯泡又变亮。
考点:离子反应方程式。
本题难度:一般
4、选择题 下列离子方程式书写正确的是( )
A.铁和稀硫酸反应:2Fe + 6H+ =2Fe 3+ +3H 2↑
B.NaHCO3溶液与NaOH溶液反应: OH
参考答案:
本题解析:
本题难度:简单
5、选择题 下列相关的表述不正确的是
A.HCO3-水解的离子方程式: HCO3-+H2O  CO32-+H3O+
CO32-+H3O+
B.电解饱和食盐水的离子方程式: 2Cl-+2H2O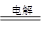 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C.加入铝粉能产生氢气的溶液中,可能存在大量的: K+、Ba2+、AlO2-、Cl-
D.向淀粉KI溶液中滴加稀硫酸,溶液变蓝: 4I-+O2+4H+= 2H2O+2I2
参考答案:A
本题解析:A、HCO3-+H2O  CO32-+H3O+为HCO3-电离方程式,不是水解的方程式,A错误;B、电解饱和食盐水的离子方程式: 2Cl-+2H2O
CO32-+H3O+为HCO3-电离方程式,不是水解的方程式,A错误;B、电解饱和食盐水的离子方程式: 2Cl-+2H2O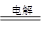 2OH-+H2↑+Cl2↑,B正确;C、加入铝粉能产生氢气的溶液,可能呈强酸性也可能呈强碱性, K+、Ba2+、AlO2-、Cl-可存在于强碱性溶液中,C正确;D、酸性条件下氧气氧化碘离子生成碘单质,: 4I-+O2+4H+= 2H2O+2I2,D正确;答案选A。
2OH-+H2↑+Cl2↑,B正确;C、加入铝粉能产生氢气的溶液,可能呈强酸性也可能呈强碱性, K+、Ba2+、AlO2-、Cl-可存在于强碱性溶液中,C正确;D、酸性条件下氧气氧化碘离子生成碘单质,: 4I-+O2+4H+= 2H2O+2I2,D正确;答案选A。
考点:离子反应、离子方程式、离子共存
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《常见的化学.. | |