|
|
|
高考化学试题《离子方程式的书写及正误判断》试题特训(2017年最新版)(五)
2017-07-10 20:00:29
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)写出下列物质在水溶液中的电离方程式(2分)
氯化铜
硫酸铁
(2)写出下列反应的离子方程式(4分)
硫酸溶液与氢氧化钡溶液混合
碳酸氢钠溶液与稀盐酸混合
2、选择题 下列离子方程式书写正确的是
A.H218O中投入Na2O2固体:2H218O+2Na2O2===4OH-+4Na++18O2↑
B.Fe3O4与稀HNO3反应:Fe3O4+8H+===Fe2++2Fe3++4H2O
C.向NaHCO3溶液中加入少量Ca(OH)2:HCO3-+Ca2++OH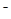 ===CaCO3↓+H2O ===CaCO3↓+H2O
D.将少量NaOH溶液加入到NH4HCO3溶液中:OH-+HCO3-===CO32-+H2O
|
3、填空题 (10分)向含0.2molAl3+的明矾溶液中逐渐加入2mol/LBa(OH)2溶液时,测得产生沉淀质量m(g)和逐渐加的2mol/LBa(OH)2溶液的体积(mL)的关系如下图,试填写空白

(1)写出OA段反应的离子方程式
OA ;
(2)m1 = V1 =
m2 = V2=
4、选择题 下列离子方程式改写成化学方程式正确的是
A.Cu2+ +2OH- =Cu(OH)2 CuCO3+2NaOH=Cu(OH)2+Na2CO3
B.CO32- + 2H+ = CO2 + H2O BaCO3 + 2HCl =BaCl2+ CO2 + H2O
C.Ca2+ + CO32- = CaCO3 Ca(NO3)2+NaCO3 = CaCO3+NaNO3
D.H+ +OH- = H2O 2KOH+H2SO4 = K2SO4 +2H2O
|
5、填空题 高铁酸盐是一种强氧化剂,在能源、环保等方面均有广泛的用途。湿法、干法制备高铁酸钾的原理如表所示:
湿法
| 强碱介质中,Fe(NO3)3与NaClO反应得到紫红色高铁酸盐溶液
|
干法
| Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾(K2FeO4)和KNO2等产物
|
(1)某工厂用湿法制备高铁酸钾的流程如图所示:
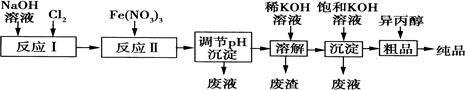
①反应I的化学方程式为
。
②反应Ⅱ的离子方程式为
。
③已知25℃时Fe(OH)3的Ksp=4.0×10—38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10—5mol·L—1.则需调整pH=
时,开始生成Fe(OH)3沉淀(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠溶液中加入饱和KOH溶液,即可析出高铁酸钾。
①已知高铁酸钠和水反应,有Fe(OH)3和O2生成,则高铁酸钠的氧化性比O2
(填“强”或“弱”)。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠
(填“大”或“小”)。
(3)高铁酸钾是一种理想的水处理剂,其处理水的原理为
。
(4)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为
。
