| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《物质的量》高频试题预测(2017年最新版)(二)
F.配制好的溶液__________(填“能”或“不能”)长期存放在容量瓶中。 参考答案:(1)①③⑤?③ 本题解析:常用的物质分离的方法:过滤、萃取分液、蒸馏、分馏,各种方法所用的物质分离仪器有:漏斗、分液漏斗、蒸馏烧瓶,故选①③⑤。其中根据物质沸点不同来分离物质的仪器是蒸馏烧瓶。A.220mL 0.2mol/L的NaOH溶液,故需要250mL容量瓶;B.用托盘天平称量氢氧化钠,称取氢氧化钠的质量为0.25L×0.2mol?L-1×40g/mol=2.0g;C.溶解氢氧化钠固体,利用玻璃棒搅拌,加速溶解;故答案为:玻璃棒;E.加水定容时,直到液面离刻度线约2-3厘米时,改用胶头滴管滴加蒸馏水至液面与刻度线相切;故答案为:胶头滴管;如果溶液未冷却就进行定容,溶液会热胀,体积偏大,相当于水的量加少了,将使配得的溶液浓度偏高。F.过长时间存放可能会造成容量瓶的腐蚀,影响测定结果,短期内用容量瓶可以暂时储存,长期最好转移到试剂瓶内保存; 本题难度:一般 3、选择题 阴离子 |
参考答案:D
本题解析:试题分析:电子的质量相对于质子和中子来说,可以忽略不计,a gX的氢化物(HnX)的物质的量为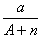 mol,HnX含有的质子数为
mol,HnX含有的质子数为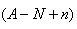 ,所以a gX的氢化物中含质子的物质的量是
,所以a gX的氢化物中含质子的物质的量是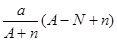 mol,答案为D。
mol,答案为D。
考点:物质的量,原子核
点评:本题考查了物质的量,原子核,是对基础知识的考查,本题有一定的难度,要理解好电子的质量相对于质子和中子来说,可以忽略不计,从而根据原子质量为质子和中子的和算出正确答案。
本题难度:简单
4、实验题
下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4 500mL的操作,请按要求填空:
(1)所需浓H2SO4的体积为__________(用下一小题的仪器量取)。
(2)如果实验室有15mL、20mL、50mL量筒,应选用_______mL量筒最好。
(3)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100mL水的烧杯里,并不断搅拌。
(4)将冷却至室温的上述溶液沿__________注入____________中,并用50mL蒸馏水洗涤烧杯2~3次,洗涤液要注入上述仪器中,并摇匀。
(5)加水至距刻度__________时,改用胶头滴管加水,使溶液的凹液面正好跟刻度相平。
(6)误差分析:请用“偏高”“偏低”或“无影响”进行填空
① 定容时,观察液面俯视:__________
② 摇匀后,液面低于刻度线,没有再加水:__________
③ 取浓H2SO4时,倒出浓H2SO4后的量筒中还残留少量液体未处理:__________
参考答案:(1)13.6mL
(2)15
(4)玻璃棒;500mL容量瓶
(5)1~2cm
(6)①偏高;②无影响;③无影响
本题解析:
本题难度:一般
5、选择题 用NA表示阿伏加德罗常数,下列有关说法正确的是
A.在常温常压下,11.2LN2含有的分子数小于0.5NA
B.在常温常压下,1mol氩气含有的原子数为2NA
C.将1 L 2 mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA
D.46gNO2和N2O4混合气体所含氧原子数目有可能为3NA
参考答案:A
本题解析:A标况下,11.2LN2含有的分子数应是0.5NA,而常温常压下,温度较高所以相同体积下含有的分子数就少。B Ar是单原子分子,因此1mol应是NA。C 氢氧化铁胶粒是由许多个氢氧化铁分子聚在一起表面吸附有铁离子直径达到1—100nm间形成的,所以应小于2NA。D 46gNO2和N2O4混合气体所含原子数一定是3NA 可以用极值法,假设46g全部是NO2或N2O4结果都是3NA,所以混合气体也是3NA。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《键参数——.. | |