微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 向盛有1mL0.1mol/LMgCl2溶液的试管中滴加1~2滴2mol/LNaOH溶液,观察到有白色沉淀生成,该反应的离子方程式是______.再滴加2滴0.1mol/LFeCl3溶液,观察到白色沉淀转化为红褐色沉淀,该反应的离子方程式是______.由以上现象可以推知,相同条件下Mg(OH)2和Fe(OH)3中溶解度较大的是______.
参考答案:向盛有1mL 0.1mol/L MgCl2溶液的试管中滴加1~2滴2mol/L NaOH溶液,MgCl2与NaOH反应生成氢氧化镁沉淀,其反应的离子方程式为:Mg2++2OH-═Mg(OH)2↓;再滴加2滴0.1mol/L FeCl3溶液,Mg(OH)2沉淀转化为溶解度更小的Fe(OH)3沉淀,其反应的离子方程式为3Mg(OH)2+2Fe3+?3Mg2++2Fe(OH)3,根据沉淀转化原理:溶解度小的物质转化为溶解度更小的容易实现,所以相同条件下Mg(OH)2和Fe(OH)3中溶解度较大的是Mg(OH)2,
故答案为:Mg2++2OH-═Mg(OH)2↓;3Mg(OH)2+2Fe3+?3Mg2++2Fe(OH)3;Mg(OH)2.
本题解析:
本题难度:一般
2、填空题 钡(Ba)和锶(Sr)及其化合物在工业上有着广泛的应用,它们在地壳中常以硫酸盐的形式存在,BaSO4和SrSO4都是难溶性盐。工业上提取钡和锶时首先将BaSO4和SrSO4转化成难溶弱酸盐。已知:
SrSO4(s)  Sr2+(aq)+SO42-(aq) Ksp=2.5×10-7
Sr2+(aq)+SO42-(aq) Ksp=2.5×10-7
SrCO3(s)  Sr2+(aq)+CO32-(aq) Ksp=2.5×10-9
Sr2+(aq)+CO32-(aq) Ksp=2.5×10-9
(1)将SrSO4转化成SrCO3的离子方程式为________________________,该反应的平衡常数表达式为____________;该反应能发生的原因是___________________________________________。(用沉淀溶解平衡的有关理论解释)
(2)对于上述反应,实验证明增大CO32-的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”、“减小”或“不变”):
①升高温度,平衡常数K将________;
②增大CO32-的浓度,平衡常数K将________。
(3)已知,SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,设计实验证明上述过程中SrSO4是否完全转化成SrCO3。
实验所用的试剂为________;实验现象及其相应结论为____________________________。
参考答案:(1)SrSO4(s)+CO32-(aq)  SrCO3(s)+SO42-(aq)? K=
SrCO3(s)+SO42-(aq)? K= ? Ksp(SrCO3)<Ksp(SrSO4),加入CO32-后,平衡SrSO4(s)
? Ksp(SrCO3)<Ksp(SrSO4),加入CO32-后,平衡SrSO4(s)  Sr2+(aq)+SO42-(aq)正向移动,生成SrCO3
Sr2+(aq)+SO42-(aq)正向移动,生成SrCO3
(2)①减小 ②不变
(3)盐酸 若沉淀完全溶解,则证明SrSO4完全转化成SrCO3,否则,未完全转化
本题解析:(1)SrSO4转化成SrCO3的离子反应为:SrSO4(s)+CO32-(aq)?SrCO3(s)+SO42-(aq),根据沉淀转化的原理,该反应能够发生,是因为Ksp(SrCO3)<Ksp(SrSO4)。(2)①降低温度有利于提高SrSO4的转化率,说明降温平衡向正反应方向移动,因此升高温度,平衡向逆反应方向移动,故平衡常数K减小。②平衡常数只与温度有关,增大CO32-的浓度,平衡常数不变。(3)根据提供的信息,可以推断SrSO4难溶于盐酸,而SrCO3可溶于盐酸,因此向溶液中加入盐酸,若沉淀全部溶解,则SrSO4完全转化成SrCO3,若沉淀没有全部溶解,则SrSO4没有完全转化成SrCO3,需要注意的是,不能选择稀硫酸,因为SrCO3与稀硫酸反应生成SrSO4。
本题难度:一般
3、选择题 向5mLNaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀谈黄色,再滴入滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系 ( )
A.AgCl=AgI=Ag2S
B.AgCl<AgI<Ag2S
C.AgCl>AgI>Ag2 S
D.AgI>AgCl>Ag2S
参考答案:C
本题解析:本题考查了沉淀的转化,根据平衡移动原理,沉淀应当向溶解度更小的沉淀转化,即向着降低离子浓度的方向进行,所以溶解度AgCl>AgI>Ag2S。
本题难度:一般
4、选择题 某课外活动小组为探究BaSO4的溶解度,分别将足量BaSO4放入:
①5 mL水
②20 mL 0.5 mol·L-1的Na2SO4溶液
③40 mL 0.2 mol·L-1的Ba(OH)2溶液
④40 mL 0.1 mol·L-1的H2SO4溶液中,溶解至饱和
以上各溶液中,c(Ba2+)的大小顺序正确的是( )
A.③>①>④>②
B.③>①>②>④
C.①>④>③>②
D.①>③>④>②
参考答案:A
本题解析:存在BaSO4(s)  Ba2+(aq)+SO
Ba2+(aq)+SO (aq),②④由于c(SO
(aq),②④由于c(SO )增大,抑制了BaSO4的溶解,使BaSO4溶解度降低,c(Ba2+)减小,但②中的c(SO
)增大,抑制了BaSO4的溶解,使BaSO4溶解度降低,c(Ba2+)减小,但②中的c(SO )大于④中的,故c(Ba2+)大小应为③>①>④>②。
)大于④中的,故c(Ba2+)大小应为③>①>④>②。
本题难度:简单
5、选择题 下列说法正确的是(? )
A.向饱和AgCl水溶液中加入盐酸,Ksp值变大
B.在一定温度下AgCl的水溶液中,Ag+和Cl-物质的量浓度的乘积是一个常数
C.25oC时Ksp(AgCl)=l.8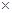 10-10,Ksp(AgI)=1.0×10-16,因此AgCl可以转化为AgI
10-10,Ksp(AgI)=1.0×10-16,因此AgCl可以转化为AgI
D.温度一定时,当溶液中Ag+和Cl-物质的量浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液
参考答案:CD
本题解析:溶度积常数只与温度有关系,A不正确;B不正确,因为该溶液不一定是饱和溶液;根据沉淀容易向溶解度更小的方向进行转化可知,C正确;根据Qc和Ksp的关系可知,D也是正确的,答案选CD。
点评:该题是中等难度的试题,也高考中的常见题型,属于中等难度的试题。该题基础性强,注重考查知识的灵活性,侧重考查学生分析问题、解决问题的能力。
本题难度:一般