微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)已知:①A、B、C、D四种物质均含有元素X,有的还有可能含有元素Y、Z。且元素Y、X、Z的原子序数依次递增。②X在A、B、C、D四种物质中都不呈现其最高化合价。③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。④化合物D受热分解,可制得元素Y的单质。试根据以上叙述回答:
(1)写出A、B、C、D的化学式::A_______B_______C_______D______。
(2)写出③、④中的两个化学方程式:
③,?④ ?。
参考答案:Cl2? KCl? KClO? KClO3
本题解析:由题意可知,X元素具有多种价态(至少4种),可得X元素一定为非金属元素,在非金属元素单质中能与某种常见一元强碱溶液反应的物质为CL2,即X元素为CL元素。化合物D受热分解,又含CL元素,所以为KCLO3,即B和C必为KCL和KCLO中的一种,综上所述:A:CL2? B与C为KCL或KCLO? D:KCLO3
③CL2+2NaOH=NaCL+NaCLO+H2O;④2KCLO3=====2KCL + 3O2↑
本题难度:一般
2、简答题 A、B、C、D、E、F六种的转化关系如图,其中A为应用最广泛的金属,氧化物E既能与盐酸反应,又能与NaOH溶液反应.X、Y属于同一周期,且核电荷数相关4.
上述转化中某些反应条件未指出,请回答下列问题:
(1)指出C中的化学键类型:______;D的化学式为______;元素X、Y的原子半径大小顺序是______(用元素符号表示).
(2)E与NaOH溶液反应的离子方程式为______.
(3)反应A+H2O→C+D的化学方程式为______.
(4)F能促进H2O的电离,其原因是______(用离子方程式表示).
(5)250C时,将pH=1的盐酸与pH=12的NaOH溶液按体积比1:9混合(混合时溶液体积变化忽略不计),混合均匀后所得溶液的pH=______.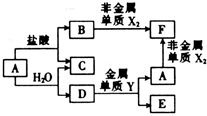
参考答案:根据题干信息氧化物E既能与盐酸反应,又能与NaOH溶液反应,可推知E为氧化铝,A为应用最广泛的金属,且能和水反应,故A应为铁,B为氯化亚铁,C为氢气,D为Fe3O4,Y为铝,
(1)非金属单质X2为氯气,F为氯化铁,氢气中的化学键是非金属元素之间所成的建,为共价键;按照元素周期表中同周期元素原子半径依次减小的递变规律,半径Al>Cl,故答案为:共价键;Fe3O4;Al>Cl;
(2)氧化铝是两性氧化物,和强碱反应得到对应的盐和水,离子方程式为:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)铁在高温下能和水蒸气发生置换反应,方程式为:Fe+4H2O(g)??高温?.??Fe3O4+4H2,故答案为:Fe+4H2O(g)?高温?.??Fe3O4+4H2;
(4)氯化铁中的Fe3+能水解,能水解的盐对水的电离均起到促进作用,水解方程式为:3Fe3++3H2O?

?Fe(OH)3+3H+,故答案为:3Fe3++3H2O?

?Fe(OH)3+3H+;
(5)设强酸和强碱的体积分别为1L和9L,强酸和强碱混合后溶液中[H+]=盐酸中氢离子的物质的量-氢氧化钠中氢氧根的物质的量溶液的总体积=0.1mol/l×1L-0.01mol/l×9L10L=0.001mol/l,PH=3,故答案为:3.
本题解析:
本题难度:一般
3、填空题 (15分)A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示。请针对以下三种不同情况回答:
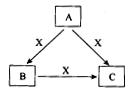
(1)若A、B、C中均含同一种常见非金属元素,将A、C的水
溶液混合可得B的沉淀
①A、B、C中含有的同一种常见非金属元素为___________。
②写出A、C的水溶液混合生成沉淀B的化学反应方程式
为?。
(2)若A为固态非金属单质,A与X同为第三周期元素,常温常压下C为白色固体,B分子中各原子最外层均为8e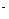 结构。
结构。
①B的电子式为_____________。
②C与水剧烈反应,生成两种常见酸,反应的化学方程式为_____________ 。
。
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生。
①A中所含有的化学键是_____________。
②将过量X通入100mL 3 mol/L? A的水溶液中,将所得溶液与明矾溶液混合,写出混合时反应的离子方程式___________。
③自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为__________ g。
参考答案:(15分、每空2分)
(1)①硫?②2H2S+SO2=3S↓+2H2O
(2)①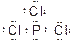 ?②PCl5+4H2O=H3PO4+5HC1。
?②PCl5+4H2O=H3PO4+5HC1。
(3)①离子键?共价键
② 3HCO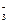 +Al3+=Al(OH)3↓+3CO2↑;
+Al3+=Al(OH)3↓+3CO2↑;
③2.65 g?(3分)
本题解析:略
本题难度:一般
4、填空题 B、D、E为中学化学常见的单质,其中D、E为金属。在一定条件下C、D间能发生反应。各物质转化关系如下图:
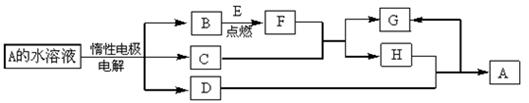
(1)B的同素异形体的名称为:_____________;H的化学式为:_____________。
(2)已知1g E在氧气中燃烧放出的热量为Q kJ,试写出表示E燃烧热的热化学方程式_____________。
(3)用惰性电极电解A 溶液的阳极反应式为:_____________。
(4)检验H和G的混合溶液中含有G的阳离子的试剂可以是:_____________。
a.氯水和KSCN溶液? b.氢氧化钠溶液? c. 酸性KMnO4溶液
(5)用惰性电极电解一定浓度的A溶液,通电一段时间后,向所得溶液中加入8.0g A的氧化物后恰好恢复到电解前的浓度和pH。则电解过程中转移电子的物质的量为_____________mol, 收集到标准状况下的气体体积为_____________。
参考答案:(1)臭氧? (2分)? Fe2(SO4)3?(2分)
(2)Fe(s)+2/3O2(g)=1/3Fe3O4(s)△H=-56QkJ/mol? (2分)
(3)4OH—-4e—=2H2O +O2↑(2分)? (4)c? (2分)?
(5)0.2mol (2分)? 1.12L(2分)
本题解析:略
本题难度:一般
5、简答题 ( I)某无色稀溶液X中,可能含有下表所列离子中的某几种.
| 阴离子 | CO32-、SiO32-、AlO2-、Cl-
阳离子
Al3+、Cu2+、Mg2+、NH4+、Na+
|
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y体积(V)的关系如图所示.
(1)若Y是盐酸,则溶液中含有的金属阳离子是______,ab段发生反应的总离子方程式为______,Oa段上表中参加反应的离子的物质的量之比为:______[要标明离子符号,如n(Na+)].
(2)若Y是NaOH溶液,则bc段反应的离子方程式为______.若不考虑离子的水解因素,忽略H+和OH-影响,且溶液中只存在四种离子,则它们的离子个数比为______[按阳离子在前,阴离子在后,高价在前,低价在后的顺序排列].
( II)锡为第IVA族元素,锡的单质和化合物与某些物质的化学性质上有许多相似之处.已知锡元素具有如下性质:①Sn4++Sn═2Sn2+;②2Sn2++O2+4H+═2Sn4++2H2O;③2H++SnO22-?Sn(OH)2?Sn2++2OH-,试回答:
(1)锡溶于盐酸,再向反应后的溶液中通入氯气,有关反应类似于铁的相应变化,试写出有关反应的化学方程式:______,______.
(2)将(1)中溶液蒸干后继续加热所得固体,变化过程类似于FeCl3溶液相应的变化,则最后得到的固体物质是(分子式)______.
(3)若可用SnCl2溶液与过量的碱溶液反应的方法制Sn(OH)2,该碱是______.

参考答案:溶液无色说明溶液中不含铜离子;
(1)如果Y是盐酸,向溶液中加盐酸,先生成沉淀,当a-b段时,沉淀的量不变化,盐酸和碳酸根离子反应生成气体,则溶液中不含镁离子、铝离子;当b-c段时沉淀的质量减少,部分沉淀和盐酸反应,部分沉淀和盐酸不反应,说明溶液中有硅酸根离子和偏铝酸根离子,弱酸根离子和铵根离子能双水解,所以溶液中含有的阳离子是钠离子,通过以上分析知,溶液中含有的阳离子是钠离子,ab段发生反应是碳酸根离子和氢离子反应生成二氧化碳和水,离子方程式为:CO32-+2H+=H2O+CO2↑;根据图象知,氢氧化铝和盐酸反应需要1V盐酸,偏铝酸根离子和硅酸根离子和盐酸反应需要盐酸4V盐酸,有关反应方程式为:AlO2-+H++H2O=Al(OH)3↓、SiO32-+2H+=H2SiO3 ↓、Al(OH)3+3H+=Al3++3H2O,根据方程式知,SiO32-生成H2SiO3需要盐酸的体积与AlO2-生成Al(OH)3需要盐酸的体积之比(4-13)13=11:1,根据AlO2-+H++H2O=Al(OH)3↓、SiO32-+2H+=H2SiO3 ↓知,则n(SiO32-):n(AlO2-)=4-132:13=11:2,
故答案为:Na+;CO32-+2H+=H2O+CO2↑;n(SiO32-):n(AlO2-)=11:2;
(2)若Y是氢氧化钠,向溶液中加氢氧化钠溶液,先生成沉淀,当a-b段时,沉淀的量不变化,氢氧化钠和铵根离子反应生成气体;当b-c段时沉淀的质量减少,部分沉淀和氢氧化钠反应,部分沉淀不反应,说明溶液中有铝根离子和镁离子,则溶液中不含硅酸根离子、碳酸根离子和偏铝酸根离子,所以溶液中含有的阴离子是氯离子.
Y是NaOH溶液,则bc段是氢氧化铝和氢氧化钠反应生成偏铝酸钠和水,离子方程式为:Al(OH)3+OH-=AlO2-+2H2O;
和铵根离子需要氢氧化钠的体积是2V,氢氧化铝和氢氧化钠反应需要氢氧化钠的体积是1V,则生成氢氧化铝需要氢氧化钠的体积是3V,生成氢氧化镁需要氢氧化钠的体积是1V,则n(Al3+):n(Mg2+):n(NH4+)=1:12:2=2:1:4,溶液中阴阳离子所带电荷相等知,n(Al3+):n(Mg2+ ):n(NH4+)、n(Cl- )=2:1:4:12,即N(Al3+):N(Mg2+ ):N(NH4+)、N(Cl- )=2:1:4:12,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;N(Al3+):N(Mg2+ ):N(NH4+)、N(Cl- )=2:1:4:12;
(II)(1)锡和盐酸反应生成二氯化锡,二氯化锡被氯气氧化生成四氯化锡,反应方程式为:Sn+2HCl=SnCl2+H2↑,SnCl2+Cl2=SnCl4,
故答案为:Sn+2HCl=SnCl2+H2↑;SnCl2+Cl2=SnCl4
(2)将氯化铁溶液蒸干所得固体是铁在高价氧化物,根据二者的相似性知,四氯化锡溶液蒸干得到锡的最高价氧化物,所以最后得到的固体是SnO2,故答案为:SnO2;
(3)根据题给信息知,Sn(OH)2具有两性,能和强碱反应,所以制取该物质时应该用弱碱,则该弱碱为NH3?H2O,故答案为:NH3?H2O.
本题解析:
本题难度:简单