微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下图为短周期的一部分,下列关于Y、Z、M元素及其化合物的说法正确的是
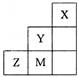
A.非金属性:Y>Z>M
B.原子半径:M>Z>Y
C.气态氢化物的稳定性:Y<M<Z
D.ZM2分子中各原子的最外层电子均满足8电子稳定结构
参考答案:D
本题解析:根据元素再周期表中的位置可判断,Y是F,Z是S,M是Cl。A不正确,非金属性应该是Y>M>Z。B不正确,原子半径是Z>M>Y。C不正确,因为非金属性越强,氢化物越稳定,即Y>M>Z。2中和的化合价分别是+2价和-1价,均满足8电子稳定结构,所以正确的答案选D。
本题难度:一般
2、选择题 已知自然界氧原子有3种16O、17O、18O,氢原子有2种H、D,从水分子的组成来看,自然界的水一共有
A.3种
B.6种
C.9种
D.12种
参考答案:C
本题解析:略
本题难度:一般
3、填空题 ( 13分)下表是元素周期表的一部分,请回答有关问题:(用元素符号)
?
| IA
| ⅡA
| ?
| ⅢA
| ⅣA
| VA
| ⅥA
| ⅦA
| 0
|
1
| a
| ?
| b
|
2
| ?
| ?
| ?
| ?
| c
| d
| e
| f
| g
|
3
| h
| ?
| i
| j
| ?
| ?
| k
| l
|
4
| m
| ?
| ?
| ?
| ?
| ?
| n
| ?
|
| | | | | | | | | |
|
(1)a元素与e元素形成的原子个数比为1:1的化合物的结构为式:_____________;
(2)n元素与f元素两者核电荷数之差是_____________________;
(3)上表中,原子半径最大的是(稀有气体除外)________________;
(4)推测j、d最简单氢化物的稳定性强弱关系____________(填化学式)。
(5)c2a4与n的单质反应的化学方程式______________________________;
(6)写出c5a12的所有同分异构体的结构简式_________________________。
参考答案:(1)H—O—O—H?(2)26?(3)K?(4)NH3 > SiH4?
(5)CH2=CH2+Br2 →CH2BrCH2Br
(6)CH3CH2CH2CH2CH3? CH3CH2CH(CH3)2? C(CH3)4 (3分)
本题解析:(1)a元素与e元素分别是H和O,二者原子个数比为1:1的化合物是H2O2,结构式为H—O—O—H。
(2)n元素与f元素分别是F和Br,二者的核电荷数之差是35-9=26。
(3)同周期自左向右,原子半径逐渐逐渐,同主族自上而下原子半径逐渐增大。所以原子半径最大的是K。
(4)j、d分别是硅和N,N的非金属性强于硅的。而非金属性越强,相应氢化物的稳定性越强,所以氢化物的稳定性是NH3 > SiH4。
(5)c2a4与n的单质分别是乙烯和单质溴,二者发生加成反应,方程式为CH2=CH2+Br2 →CH2BrCH2Br。
(6)c5a12是戊烷,共有3种同分异构体,分别是CH3CH2CH2CH2CH3、CH3CH2CH(CH3)2、C(CH3)4。
本题难度:一般
4、选择题 俄罗斯科学家宣布在实验中获得了 和
和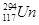 两种新原子。下列有关
两种新原子。下列有关 和
和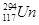 的说法错误的是(? )
的说法错误的是(? )
A.质量数均超过质子数的两倍
B.互称为同位素
C.中子数分别为176、177
D.是同一种核素
参考答案:D
本题解析: 和
和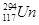 是Un元素的两种不同核素,二者互为同位素;这两种原子的质子数都是117,中子数分别为176、177,质量数分别为293、294,质量数均超过质子数的两倍。
是Un元素的两种不同核素,二者互为同位素;这两种原子的质子数都是117,中子数分别为176、177,质量数分别为293、294,质量数均超过质子数的两倍。
本题难度:简单
5、实验题 某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:
实验方案
| 实验现象
|
①用砂纸打磨后的镁带与沸水反应,再向反应液中滴加酚酞。
②向新制的H2S饱和溶液中滴加新制的氯水
③钠与滴有酚酞试液的冷水反应
④镁带与2mol/L的盐酸反应
⑤铝条与2mol/L的盐酸反应
|
A.浮于水面,熔成小球,四处游动,逐渐缩小,溶液变红色
B.产生气体,气体可燃,溶液变浅红色
C.反应不十分强烈,产生的气体可燃
D.剧烈反应,产生的气体可燃
|
E.生成淡黄色沉淀