微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,用蒸馏水逐渐稀释0.1mol·L-1的氨水,下列各数值不会逐渐增大的是
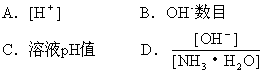
参考答案:C
本题解析:对弱电解质的稀溶液来说,在加水稀释的过程中,电离生成的离子结合成弱电解质的可能性减小,其电离程度增大,电离出的离子个数增多,但由于溶液的体积变化大,离子浓度反而减小。氨水中存在以下电离平衡:NH3+H2O NH4++OH-,H2O
NH4++OH-,H2O H++OH-,由于思维定势,弱碱溶液中仅讨论有关氢氧根离子的量,忽略了氢离子量的讨论。而碱溶液中氢离子浓度增大,似乎酸性增强,选择了A选项。实际上氨水在稀释过程中,氢氧根离子个数增多,氢氧根浓度减小。在酸、碱的稀溶液中,水的离子积不变,因此氢离子浓度增大。但氢离子浓度始终小于氢氧根离子浓度,溶液显碱性,选项A不符合本题题意要求。选项D中的氢氧根离子浓度和氨水的浓度随着氨水稀释过程都减小,但减小的速率不易直观判断。显然随氨水稀释,电离程度增大,比值也增大,因此选项D也不符合本题题意要求。由于氢离子浓度增大,溶液pH只能减小,选项C为本题正确答案。?
H++OH-,由于思维定势,弱碱溶液中仅讨论有关氢氧根离子的量,忽略了氢离子量的讨论。而碱溶液中氢离子浓度增大,似乎酸性增强,选择了A选项。实际上氨水在稀释过程中,氢氧根离子个数增多,氢氧根浓度减小。在酸、碱的稀溶液中,水的离子积不变,因此氢离子浓度增大。但氢离子浓度始终小于氢氧根离子浓度,溶液显碱性,选项A不符合本题题意要求。选项D中的氢氧根离子浓度和氨水的浓度随着氨水稀释过程都减小,但减小的速率不易直观判断。显然随氨水稀释,电离程度增大,比值也增大,因此选项D也不符合本题题意要求。由于氢离子浓度增大,溶液pH只能减小,选项C为本题正确答案。?
本题难度:简单
2、填空题 今有a(CH3COOH)、b(HCl)、c(H2SO4)三种溶液:
(1)当它们的c(H+)相同时,其物质的量浓度的关系是______。(用a、b、c表示)
(2)当它们的物质的量浓度相同时,其c(H+)的关系是______。(用a、b、c表示)
(3)中和同一烧碱溶液,需物质的量浓度相同的三种溶液的体积关系是______。(用b、c表示)
(4)体积、浓度都相同的b、c两溶液,分别与同浓度的NaOH溶液反应使反应后溶液呈中性,所需NaOH溶液的体积关系是_____。(用b、c表示)
参考答案:(1)a>b>c
(2)c>b>a
(3)a=b<c
(4)b=1/2c
本题解析:
本题难度:一般
3、选择题 室温下,CH3COOH的Ka=1.7×10-5mol?L-1,NH3?H2O的Kb=1.7×10-5mol?L-1,下列说法不正确的是( )
A.室温下,相同浓度的CH3COOH与NH3?H2O的电离程度相同
B.温度升高,Ka增大、Kb减小
C.室温下,CH3COOH溶液中的c(H+)与NH3?H2O中的c(OH-)相等
D.室温下,相同物质的量浓度时,CH3COOH溶液中的c(H+)与NH3?H2O中的c(OH-)相等
参考答案:A.室温下,醋酸溶液中c(H+)=
本题解析:
本题难度:一般
4、选择题 将浓度为0.1 mol/LCH3COOH溶液稀释10倍后,下列微粒浓度减小得最多的是
[? ]
A. CH3COOH
B. OH-
C. H+
D. CH3COO-
参考答案:A
本题解析:
本题难度:一般
5、填空题 某二元酸(用H2A表示)在水中的电离方程式是:H2A=H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)NaHA溶液________(填“显酸性”、“显碱性”、“显中性”或“酸碱性无法确定”),原因是______________________。
(2)某温度下,向0.1? mol·L-1的NaHA溶液中滴入0.1 mol·L-1 KOH溶液至中性,此时溶液中以下关系一定正确的是________(填字母)。
A.c(H+)·c(OH-)=1×10-14 mol·L-1
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05 mol·L-1
参考答案:(1)显酸性 HA-只电离不水解 (2)BC
本题解析:(1)由题给电离方程式知:HA-只电离不水解,所以NaHA溶液显酸性。(2)溶液显中性,则c(H+)=c(OH-),根据电荷守恒有:c(H+)+c(Na+)+c(K+)=c(OH-)+c(HA-)+2c(A2-),则c(Na+)+c(K+)=c(HA-)+2c(A2-);加入KOH溶液,发生反应HA-+OH-=A2-+H2O,A2-水解使溶液显碱性,所以,加入的KOH的物质的量小于NaHA的物质的量,c(Na+)>c(K+)。
本题难度:一般