微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A的原子半径最小,B与A能以原子个数1:1、1:2或1:3等组成多种常见化合物;C的最高正价和最低负价的代数和为2;D与F位于同一主族;E与D能以原子个数1:1或2:1形成两种常见化合物.
(1)A与B能形成一种最简单的直线型分子,其电子式为?。
(2) CA3极易溶于液态A2D中,其原因 是?。
是?。
(3)将标准状况下的4.48 L CA3完全溶解在含0.1mol HCl的水溶液中得1L溶液,所得溶液pH=9,其中离子浓度由大到小的顺序是?。
(4)物质B2A6D在电解质EDA 的溶液作用下,可形成燃料电池,则该电池的负极反应式为?。
的溶液作用下,可形成燃料电池,则该电池的负极反应式为?。
(5)E与F形成的化合物属于?型化合物(填:离子或共价),用惰性电极电解该化合物的水溶液时,有固体析出,则电解总反应方程式为?。
参考答案:

本题解析:略
本题难度:一般
2、填空题 (9分).A~L是由6种短周期元素组成的物质,各物质之间有如下转化关系: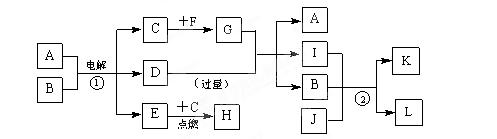
已知:(a) C、E是气体单质,F是日常生活中的常用金属;(b) B、J是氧化物,且J是能使澄清石灰水变浑浊的无色无味气体;(c)化合物A、D、I、L的焰色反应显黄色;(d)白色沉淀K既溶于H溶液,又能溶于D溶液;(e)反应①是工业上生产D和C的重要方法。请回答:
(1)写出F的化学式?,D的电子式?,J的结构式?。
(2)写出有关反应的化学方程式:
反应①?;
反应②? ?。
?。
(3)L溶液和G溶液混合能发生反应,其离子方程式为?。
参考答案:(1)各1分,其余各2分
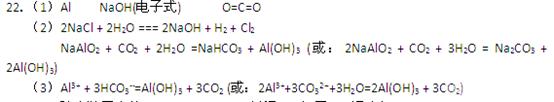
本题解析:略
本题难度:一般
3、推断题 E为无色无味的液体,F为淡黄色粉末,G (反应条件均已略),请回答下列问题:
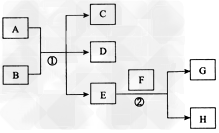
(1)请写出F的电子式:_______;在反应②中,当生成2.24L(标准状况)的G时,反应转移的电子数目为___________
(2)若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出在稀溶液中①的离子方程式:___________________。
(3)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B为___________(填名称)。
(4)若A与B均为固体化合物,C是常见的一种中性干燥剂,则反应①的化学方程式为____________________。
参考答案:(1)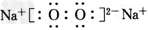 ;0.2NA或1.204×1023
;0.2NA或1.204×1023
(2)Cl2+2OH-=Cl-+ClO-+H2O
(3)碳、浓硫酸
(4)2NH4Cl+Ca(OH)2 CaCl2+2H2O+2NH3↑
CaCl2+2H2O+2NH3↑
本题解析:
本题难度:一般
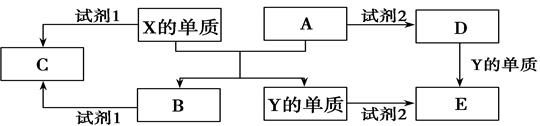
4、填空题 A、B、C、D、E是中学常见的几种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如下图所示。
回答下列问题:
(1)X的单质与A反应的化学方程式是________________________________。
(2)若C溶液显碱性,则试剂1是? ____溶液(写化学式);若C溶液显酸性,则显酸性的原因是(用离子方程式表示)?。
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是?;
②写出D→E反应的离子方程式?;
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠(NaNO2)为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是:?。
参考答案:(1)2Al+Fe2O3 2Fe+Al2O3
2Fe+Al2O3
(2)NaOH(或OH-) Al3++3H2O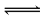 Al(OH)3+3H+
Al(OH)3+3H+
(3)①取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色;则证明原溶液含有Fe3+
②2Fe3++Fe=3Fe2+?③2FeSO4+2NaNO2+H2SO4=2Fe(OH)SO4+Na2SO4+2NO↑
本题解析:元素X、Y的单质是生活中常见的金属,Y的用量最大,则X为Al,Y为Fe,A、B是氧化物,则Al与氧化铁反应生成Fe和氧化铝;Al、氧化铝都既能与酸反应又能与碱反应,而Fe、氧化铁都能与酸反应,若C溶液显碱性,则试剂1为NaOH溶液时,C为偏铝酸钠;若C溶液为酸性,C为强酸对应的铝盐,试剂2为硫酸时,D为硫酸铁、E为硫酸亚铁;试剂1为硫酸时,C为硫酸铝,该溶液水解显酸性,
(1)X的单质与A反应为铝热反应,即Al与氧化铁反应生成氧化铝和Fe,该反应为Fe2O3+2Al
Al2O3+2Fe,
(2)若C溶液为碱性,试剂1是NaOH溶液,①Al与NaOH溶液反应生成偏铝酸钠和氢气,离子反应为2Al+2H2O+2OH-═2AlO2-+3H2↑,故答案为:2Al+2H2O+2OH-═2AlO2-+3H2↑;若C溶液显酸性,则显酸性的原因是Al3++3H2O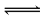 Al(OH)3+3H+
Al(OH)3+3H+
(3)若试剂1和试剂2均是稀硫酸,
①D为硫酸铁,检验铁离子的方法为取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+,
故答案为:取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+;
②写出D→E反应的离子方程式2Fe3++Fe=3Fe2+;
③E为硫酸亚铁,与稀硫酸和亚硝酸钠为原料生成Fe(OH)SO4,反应中有NO生成,该反应为2FeSO4+2NaNO2+H2SO4═2Fe(OH)SO4+Na2SO4+2NO↑,
故答案为:2FeSO4+2NaNO2+H2SO4═2Fe(OH)SO4+Na2SO4+2NO↑.
本题难度:一般
5、填空题 如图所示,已知:
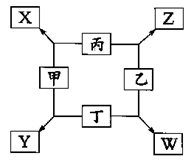
①甲、乙、丙、丁均为前三周期元素的单质,甲、乙、 丙常温下为气体。
②在一定条件下甲与丙和甲与丁都按物质量之比l:3反应,分别生成X和Y,在产物中元素甲呈负价。
③在一定条件下乙与丙和乙与丁都按物质的量之比1:2反应,分别生成Z和W,在产物中元素乙呈负价。
请填空:
(1)W的电子式为 ;
(2)X与乙催化氧化的化学方程式是______________________________________________;
(3)Y与Z反应的化学方程式是_____________________________________________;
(4)2.4g丁与足量的乙反应生成W放出QkJ的热,则该反应的热化学方程式为?;
(5)实验室制取丙的离子方程式为?。
参考答案:(1) 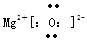 ?(2分)
?(2分) ?
?
(2)4NH3+5O2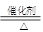 4NO+6H2O (2分)
4NO+6H2O (2分)
(3)Mg3N2+6H2O=3Mg(OH)2+2NH3↑(2分,产物写成NH3·H2O也对。)
(4)2Mg(s)+O2(g)= 2MgO(s)?△H=-20QkJ·mol-1(2分)
(5)Zn+2H+=Zn2++H2↑(2分)
本题解析:甲、乙、丙均为前三周期元素的气体单质,可能为H2、O2、N2、Cl2,在一定条件下甲与丙、甲与丁都按微粒个数比1:3组成X和Y,在产物中元素甲呈负价,丙和丁显正价,说明甲是非金属元素形成的单质N2,丙为H2,X为NH3,Y为Mg3N2;在一定条件下乙与丙、乙与丁都按物质的量之比1:2反应,在产物中元素乙呈负价,说明乙是非金属元素.所以乙为O2,分别生成Z为H2O,W为MgO。
W为MgO含离子键,可写出电子式。
X为NH3,乙为O2,催化氧化生成NO、H2O,4NH3+5O2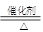 4NO+6H2O
4NO+6H2O
Y为Mg3N2,Z为H2O,发生水解反应:Mg3N2+6H2O=3Mg(OH)2+2NH3↑
2.4gMg为0.1mol,化学方程式中Mg的系数为2,所以?H-20QkJ·mol-1,进而写出热化学方程式:2Mg(s)+O2(g)=2MgO(s)?△H=-20QkJ·mol-1。
丙为H2,实验室制取氢气的离子方程式为:Zn+2H+=Zn2++H2↑。
本题难度:困难