|
高考化学试题《无机综合与推断》高频考点特训(2017年练习版)(八)
2017-07-10 20:17:00
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 下面是有关物质的转化关系图(部分产物已省略),其中A为单质,E在常温下为液体,D是一种温室气体,C的相对分子质量为78。请回答相关问题。
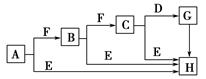
(1)下列对C的结构、性质推断中不正确的是? ( )。
A.久置于空气中会变成白色
B.具有强氧化性
C.晶体中存在离子键与非极性键
D.是一种碱性氧化物
| (2)A的原子结构示意图为____________________,H的电子式为________________ 91EXAM.org____,E的结构式为____________________。
(3)C和E反应生成H的离子方程式为__________________,反应中氧化剂与还原剂的物质的量之比为______。
参考答案:(1)D (2) ? ? ? ?  (3)2Na2O2+2H2O=4Na++4OH-+O2↑ 1∶1 (3)2Na2O2+2H2O=4Na++4OH-+O2↑ 1∶1
本题解析:由题知,E可能为水,A→B→C连续反应,可能为连续氧化,能发生连续氧化的单质有Na、S、C、N2,单质、两种氧化物均能与水反应,只有钠、氧化钠、过氧化钠,过氧化钠的相对分子质量为78,验证正确。则A为钠、F为氧气,B为氧化钠,C为过氧化钠,D为二氧化碳,H为氢氧化钠。(1)A项,Na2O2放置空气中最终变成白色的Na2CO3,正确;B项,Na2O2中-1价的氧既有氧化性又有还原性,以强氧化性为主,正确;C项,Na+与O22—间存在离子键,O22—内部存在非极性共价键,正确;D项,Na2O2与酸反应除生成盐和水外还有O2生成,不是碱性氧化物。
本题难度:一般
2、填空题 [2012·临沂一模](10分)下列转化关系所涉及的物质都是中学化学常见物质。已知A、B为氧化物,C为固体单质,D为黄绿色气体。
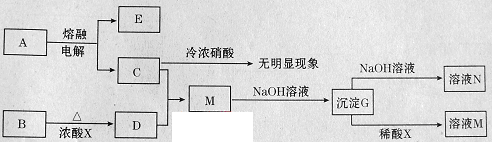
请回答:
(1)指出A中存在的化学键类型:?。
(2)写出M与过量氨水反应的离子方程式:?。
(3)向溶液N中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是?
_____________?________。
(4)电解熔融氧化物A,阳极的电极反应方程式为?。
(5)B与浓酸X反应的化学方程式为?。
(6)能不能直接蒸发溶液M得到M晶体??(填“能”或“不能”)。若能,不用回答;若不能,回答该如何操作??。
参考答案:(10分)(1)离子键
(2)Al3++3NH3·H2O=Al(OH)3↓+3NH4+
(3)通入过量CO2气体有白色沉淀生成;加入过量稀盐酸有气体产生,沉淀溶解
(4)2O2-—4e-=O2↑
(5)MnO2+4HCl MnCl2+Cl2↑+2H2O? MnCl2+Cl2↑+2H2O?
(6)不能?应在HCl气流中加热蒸发结晶
本题解析:电解熔融氧化物A得到固体单质C,且C遇冷浓硝酸无现象,由此可判断C是金属铝,A是Al2O3;D为黄绿色气体,则D是Cl2,通常用MnO2和浓盐酸制Cl2,所以氧化物B是MnO2,浓酸X是浓盐酸,铝与氯气反应得到的M为AlCl3,AlCl3与NaOH溶液反应首先生成Al(OH)3沉淀,然后Al(OH)3溶于NaOH溶液得NaAlO2溶液,即N是NaAlO2。(3)向NaAlO2溶液中通入过量二氧化碳发生反应AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,加入过量稀盐酸后发生反应HCO3-+H+=CO2↑+H2O和Al(OH)3+3H+=Al3++H2O,所以反应现象为:通入CO2气体有白色沉淀生成;加入盐酸盐酸有气体产生,沉淀溶解。(6)AlCl3是强酸弱碱盐,在水溶液里易发生水解:AlCl3+3H2O Al(OH)3+3HCl,加热蒸发时HCl挥发,水解平衡右移,所以直接蒸发AlCl3溶液得到的固体是Al(OH)3。 Al(OH)3+3HCl,加热蒸发时HCl挥发,水解平衡右移,所以直接蒸发AlCl3溶液得到的固体是Al(OH)3。
本题难度:一般
3、填空题 (10分)A、B、C、D、E是中学化学中常见的无色气体,它们均由短周期元素组成。A、B、C相互转化关系如图所示(部分产物已略去)。已知:? A能使湿润的红色石蕊试纸变蓝;C、D为空气中的主要成分;B、E是有毒气体,都能和血红蛋白结合。
回答下列问题:
(1)A的结构式?,C的电子式?。
(2)下列气体实验室制取装置与用氯化铵和碱石灰加热制取A的装置相同的是?(填序号)。
①氧气?②氯气?③氢气?④二氧化碳
(3)反应②可用于汽车加装尾气催化净化装置,可以使B和E转化成无毒的气体,试写出反应②的化学方程式:?。
(4)反应①的化学方程式:?。
参考答案:(1) (2 ①?(3)2NO+2CO (2 ①?(3)2NO+2CO  ?N2+2CO2 ?N2+2CO2
?(4)4NH3+5O2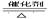 4N O+6H2O(催化剂不写扣1分) 4N O+6H2O(催化剂不写扣1分)
本题解析:A能使湿润的红色石蕊试纸变蓝,说明A是氨气。B、E是有毒气体,都能和血红蛋白结合,因此它们是CO和NO。空气中的主要成分是氧气和氮气,因为氨气和氧气能发生反应,但和氮气不反应,所以D是氧气,B是NO,E是CO,C是氮气。实验室制取氨气是利用熟石灰和氯化铵在加热的条件下进行的,因此属于固体和固体之间通过加热制取气体的。氯气、氢气和CO2均是固体和液体之间反应制取气体,但制取氯气需要加热,因此都不符合。氧气属于固体和固体之间加热制取气体的,符合题意,所以正确的答案是①。
本题难度:一般
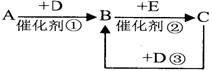
4、填空题 (已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素。在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去)。

请回答下列问题:
若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质
①加热蒸干B的溶液不能得到B,则B的化学式可能是________________;工业上制取A的离子方程式为__________________________________。
②用A制备漂白粉的化学方程式是________________________________________________。反应②的离子方程式是______________________________________________________,配制C的溶液时可加入少量的______(填物质名称)以抑制水解。
(2)若A是某强酸的稀溶液,则A的化学式可能是________。
(3)若D是氯碱工业的主要产品之一,B有两性,则反应②的离子方程式是________________________。?
(4)若A、B、C的的焰色反应都呈黄色,D是气态酸性氧化物,则D可能是______或______(填化学式),鉴别这两种气态酸性氧化物常可选用________________(填一种试剂名称)。
参考答案:(1) ①FeCl3?(2分)? 2Cl-+2H2O 2OH-+Cl2↑+H2↑(2分) 2OH-+Cl2↑+H2↑(2分)
②2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(2分)? Fe+2Fe3+=3Fe2+? (2分)?盐酸(2分)
(2)HNO3(2分,只要符合题意都给分)
(3)Al(OH)3+OH-=[Al(OH)4]-或Al(OH)3+OH-=AlO2- + 2H2O (2分)
(4)CO2?SO2?品红溶液、溴水或酸性高锰酸钾溶液等(共3分,每空1分。只要符合题意都给分)
本题解析:(1)根据D是生产、生活中用量最大、用途最广的金属单质可判断D为Fe。
①若A可用于自来水消毒,则A为Cl2。氯气与铁反应生成氯化铁,则B是氯化铁。工业上通过电解饱和食盐水制备氯气,所以工业上制取A的离子方程式为2Cl-+2H2O 2OH-+Cl2↑+H2↑。 2OH-+Cl2↑+H2↑。
②用氯气制备漂白粉的化学方程式是氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;氯化铁与铁反应生成氯化亚铁,则C为FeCl2,所以反应②的离子方程式为Fe+2Fe3+=3Fe2+。亚铁离子易水解,因此配制FeCl2的溶液时可加入少量盐酸可以防止亚铁离子的水解。
(2)若A是某强酸的稀溶液,实现上述转化必须要求酸是氧化性酸,因此可判断为HNO3。
(3)若D是氯碱工业的主要产品之一,B有两性,所以B为两性氢氧化物为Al(OH)3,因此D是氢氧化钠,所以能确定A、C中肯定含的离子的化学式分别是:AlO2-、Al3+,则反应②的离子方程式是Al(OH)3+OH-=[Al(OH)4]-或Al(OH)3+OH-=AlO2- + 2H2O。
(4)若A、B、C的焰色反应都呈黄色,证明含有钠元素,D是气态酸性氧化物实现上述变化,D可以是CO2,SO2。SO2具有漂白性和还原性,因此可以用品红溶液、溴水或酸性高锰酸钾溶液等鉴别。
本题难度:一般
5、简答题 已知A、B、C、D为气体,其中A呈黄绿色,D极易溶于水,形成的溶液可使酚酞变红.它们之间的转化关系如图1所示:

(1)将B点燃,把导管伸入盛满A气体的集气瓶,可以观察到的实验现象有(填序号)______.
①放热②黄绿色褪去 ③瓶口有白烟
④瓶口有白雾⑤安静燃烧,发出黄色火焰⑥安静燃烧,发出苍白色火焰
(2)实验室制D的化学方程式为______.
(3)实验室可用如图2所示装置收集D,下列叙述正确的______(填序号).
①D气体不能用排水法收集 ②干燥管里盛有碱石灰 ③右图中的a为浸有稀H2SO4的棉花
(4)工业生产D的化学方程式是______.
(5)检验E中阳离子的方法是:取少量E于试管中,______.
参考答案:A为黄绿色气体,应为Cl2,D极易溶于水,形成的溶液可使酚酞变红,应为NH3,则C应为HCl,B为H2,则E为NH4Cl,
(1)B为H2,在氯气中燃烧时生成HCl,因HCl易溶于水,则可观察到有白雾生成,反应放热,黄绿色褪去,发出苍白色火焰等现象,
故答案为:①②④⑥;
(2)实验室用氢氧化钙和氯化铵反应制备氨气,反应的方程式为Ca(OH)2+2NH4Cl△. CaCl2+2NH3↑+2H2O,
故答案为:Ca(OH)2+2NH4Cl△.CaCl2+2NH3↑+2H2O;
(3)氨气易溶于水,具有碱性,与硫酸反应,密度比空气小,可用向下排空法收集,故答案为:①②;
(4)工业生产NH3的化学方程式是N2+3H2高温、高压
本题解析:
本题难度:简单
|