微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 甲、乙、丙、丁四种物质(可以是溶液)中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系: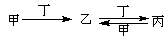 。按要求回答下列问题:
。按要求回答下列问题:
(1)若甲为碳,则乙为________(填化学式,下同),丙为_________。
(2)若甲为氯气,则丁为_______,丙为_________。
(3)若甲为二氧化硫,丁为氢氧化钠溶液,则丙→乙的离子方程式为_____________。
(4)若甲为氯化铝溶液,丁为氢氧化钠溶液,则乙→丙的离子方程式为_____________。
参考答案:(1)CO;CO2?(2)Fe;FeCl2
(3)SO32-+SO2+H2O=2HSO3-?(4)3AlO2-+Al3++6H2O=4Al(OH)3↓
本题解析:(1)由于甲、乙能连续与丁反应,且丙还能与价反应生成乙。则如果甲是碳,则符合转化关系的丁应该是氧气,乙是CO,丙是CO2。
(2)若甲为氯气,则丁应该是变价的金属,所以丁是铁,乙是氯化铁。在溶液中氯化铁能和铁反应生成氯化亚铁,即丙是氯化亚铁。氯化亚铁被氯气氧化又转化为氯化铁。
(3)若甲为二氧化硫,丁为氢氧化钠溶液,则乙应该是亚硫酸氢钠,丙是亚硫酸钠,所以丙→乙的离子方程式为SO32-+SO2+H2O=2HSO3-。
(4)若甲为氯化铝溶液,丁为氢氧化钠溶液,则乙应该是氢氧化铝。丙是偏铝酸钠,则乙→丙的离子方程式为Al(OH)3 + OH-=AlO2-+2H2O
本题难度:一般
2、选择题 A、B、C、D、E是原子序数逐渐增大的5种短周期元素,A与B组成的化合物BA4是具有温室效应的气体之一,B与D、C与D组成的化合物是机动车排出的大气污染物,D和E能形成原子个数比为1:1和1:2的两种离子化合物.下列说法不正确的是( )
A.B在元素周期表中的位置是第二周期IVA族
B.工业合成CA3的反应是放热反应,增大压强能加快反应速率,又能提高原料转化率
C.气态氢化物的沸点:C>D
D.C和E组成的一种离子化合物,能与水反应生成两种碱
参考答案:C
本题解析:
本题难度:一般
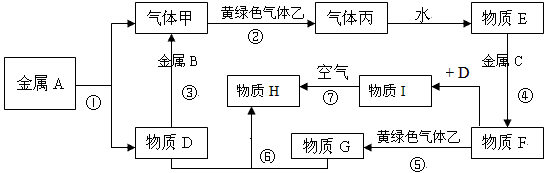
3、推断题 它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A、___________C、___________丙、___________;
(2)写出反应③的化学方程式______________________, 写出反应⑤的离子方程式______________________,写出反应⑦的化学方程式______________________;
(3)冶炼金属A、B一般用___________法,冶炼金属C一般用___________法
参考答案:(1)Na;Fe;HCl
(2)2Al+2NaOH+2H2O==2NaAlO2+3H2↑;2Fe2++Cl2==2Fe3++2Cl-;4Fe(OH)2+2H2O+O2==4Fe(OH)3
(3)电解法;热还原
本题解析:
本题难度:一般
4、简答题 选做题:图表示某些化工生产的流程(部分反应条件和产物略去):

(1)反应I需在500℃进行,其主要原因是______.
(2)H转化为N的过程中,需要不断补充空气,其原因是______.
(3)写出反应Ⅲ的化学方程式______.
(4)工业上,向析出K的母液中通氨气,加入细小食盐颗粒,冷却后可析出副产品.通入氨气的作用是______(填序号).
a.增大NH4+的浓度,使J更多地析出
b.使K更多地析出
c.使K转化为M,提高析出的J的纯度
(5)写出上述流程所涉及的化学工业的名称______.
参考答案:液态空气蒸馏主要得到O2和N2,焦炭和水蒸气在高温下反应生成CO和H2,二者得到的气体B、C在催化剂条件下能发生反应,则应为N2和H2的反应,生成的气体为NH3,所以,A为O2,B为N2,C为H2,D为CO,E为NH3,NH3和O2在催化剂条件下发生氧化还原反应生成NO,NO与反应生成NO2,进而与水反应生成,所以,G为NO,H为NO2,I为HNO3,L为NH4NO3,CO和O2反应生成CO2,CO2、NaCl和NH3反应生成NaHCO3,为侯氏制碱法的主要反应,NaHCO3加热分解生成Na2CO3,则F为CO2,
J为NH4Cl,K为NaHCO3,M为Na2CO3;
(1)反应I是工业合成氨气的反应,需在500~℃进行,其主要原因是此温度下催化剂活性最高;故答案为:此温度下催化剂活性最高;
(2)H转化为N的过程中是二氧化氮和水反应生成硝酸和一氧化氮的反应,反应是化学平衡,需要不断补充空气使一氧化氮气体不断转化为二氧化氮,提高原料的利用率,故答案为:使一氧化氮气体不断转化为二氧化氮,提高原料的利用率;
(3)反应Ⅲ是候氏制碱法的反应原理,氨化的饱和食盐水中通入二氧化碳生成碳酸氢钠晶体和氯化铵,反应的化学方程式为:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl;
故答案为:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl;
(4)工业上,向析出K的母液为氯化铵中通氨气,加入细小食盐颗粒,冷却后可析出副产品J氯化铵,通入氨气的作用是增大铵根离子浓度使氯化铵晶体析出,氨气溶于水后生成氨水,氨水电离成铵根,增大铵根的浓度有利于氯化铵的析出来分析;同时通入氨气使溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度;故答案为:ac;
(5)上述流程所涉及的化学工业的名称为:工业合成氨、氨气的催化氧化、侯德榜制碱法;故答案为:工业合成氨、氨气的催化氧化、侯德榜制碱法;
本题解析:
本题难度:一般
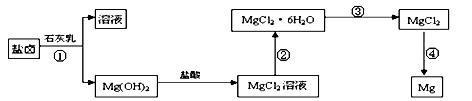
5、填空题 某研究性学习小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产提取 镁,主要过程如下:
镁,主要过程如下:
 ?回答下列问题:
?回答下列问题:
(1)从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2 ,除去少量Ca(OH)2的方法是先将沉淀加入到盛有?饱和溶液的烧杯中,充分搅拌后经?、?(填操作方法)可得纯净的Mg(OH)2。写出有关反应的离子方程式?。
(2)右图是该研究性学习小组设计进行过程③的实验装置图。其中装置A的作用是? ?。
?。
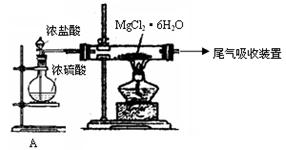
若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是?
??。
(3)写出过程④中发生反应的化学方程式
?。
参考答案:(1)MgCl2(或氯化镁)(2分)?过滤(2分)?洗涤(2分)
Mg2+?+? Ca(OH)2 = Mg(OH)2?+? Ca2+?(3分)
(2)制备干燥的HCl气体,抑制MgCl2的水解。(3分)
用铂丝蘸取少量固体,置于酒精灯火焰上灼烧,若无黄色火焰产生,则证明所得无水氯化镁晶体中不含氯化钠。(2分)(答焰色反应也给分)
(3)MgCl2(熔融) Mg +Cl2↑(2分)
Mg +Cl2↑(2分)
本题解析:略
本题难度:一般