微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 X、Y都是IIA(Be除外)的元素,已知它们的碳酸盐的热分解温度:T(XCO3)>T(YCO3),则下列判断正确的是(?)
A.晶格能: XCO3>YCO3
B.阳离子半径: X2+>Y2+
C.金属性: X>Y
D.氧化物的熔点: XO>YO
参考答案:AD
本题解析:形成离子晶体的离子半径越小,电荷数越多,离子键越强,熔点越高。所以根据碳酸盐的分解温度可知X的离子半径小于Y的离子半径,同主族自上而下离子半径逐渐增大,所以X的金属性弱于Y的,AD正确,BC错误,答案选AD。
本题难度:一般
2、选择题 短周期元素X、Y、Z、R在周期表中的位置如图。下列说法正确的是
?
A.气态氢化物的稳定性:X > Y
B.原子半径大小:Y> Z
C.X和Y形成的化合物是离子化合物
D.Z、R的最高价氧化物对应的水化物都是强酸
参考答案:D
本题解析:观察图中元素的位置可得:X、Y位于第二周期第VA族、第VIA族,Z、R位于第三周期第VIA族、第VIIA族,则X、Y、Z、W分别是氮、氧、硫、氯。X、Y是氮和氧,氮的非金属性小于氧,则前者的气态氢化物的稳定性小于后者,故A选项错误;Y、Z是氧和硫,氧原子的电子层数小于硫原子,则前者的原子半径小于后者,故B选项错误;X、Y是氮和氧,氮和氧都是非金属元素,二者形成的氮氧化合物都是共价化合物,故C选项错误;Z、R是硫和氯,硫和氯的最高价氧化物对应的水化物分别是硫酸和高氯酸,硫酸和高氯酸都是强酸,故D选项正确。
本题难度:一般
3、选择题 人们对原子结构的认识有一个不断深入的过程,下列先后顺序中符合史实的是
①道尔顿提出的原子论?②卢瑟福的原子结构行星模型
③波尔提出的原子力学模型?④汤姆生提出的葡萄干面包原子模型
A.①④②③
B.①②④③
C.②①④③
D.①③②④
参考答案:A
本题解析:首先道尔顿提出的原子论,然后汤姆生提出的葡萄干面包原子模型,然后卢瑟福通过散射实验,提出原子结构行星模型,最后波尔提出原子力学模型,故A项正确,答案选A。
本题难度:简单
4、选择题 按能量由低到高的顺序排列,正确的一组是? (? )
A.1s、2p、3d、4s
B.1s、2s、3s、2p
C.2s、2p、3s、3p
D.4p、3d、4s、3p
参考答案:C
本题解析:原子轨道能量的高低(也称能级)主要由主量子数n和角量子数l决定。当l相同时,n越大,原子轨道能量E越高,例如E1s<E2s<E3s;E2p<E3p<E4p。当n相同时,l越大,能级也越高,如E3s<E3p<E3d。故C正确
点评:本题主要考察能级能量大小的比较,属于简单题,掌握从低能级到高能级,电子能量逐渐增大是解题的关键。
本题难度:简单
5、填空题 下图是元素周期表的一部分,请回答:
族
周期
| ⅠA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| 0
|
1
| ①
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
2
| ?
| ?
| ?
| ②
| ?
| ③
| ④
| ?
|
3
| ?
| ⑤
| ⑥
| ?
| ?
| ?
| ⑦
| ⑧
|
4
| ⑨
| ?
| ?
| ?
| ?
| ?
| ⑩
| ?
|
⑴元素⑦的原子结构示意图为______________;元素⑩的名称为______________。
⑵在这些元素中,化学性质最活泼的金属元素是___________(填元素符号,下同),最不活泼的元素是______________;原子半径最小的元素是______________。
⑶这些元素的最高价氧化物对应的水化物中,酸性最强的是______________(填化学式,下同);具有两性的是______________。
⑷写出元素④和⑤形成化合物的电子式______________,用电子式表示元素⑦和⑨所形成化合物的形成过程________________________________________________________。
参考答案:(1)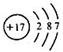 ?溴 (每空1分)(2)K? Ar? H (每空1分)
?溴 (每空1分)(2)K? Ar? H (每空1分)
(3)HClO4? Al(OH)3?(每空1分)
(4)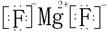 (1分)
(1分)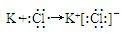 ?(2分)
?(2分)
本题解析:根据元素在周期表中的位置可知,①~⑩分别是H、C、O、F、Mg、Al、Cl、Ar、K、Br。
(1)氯元素的原子序数是17,则氯原子的原子结构示意图是 。
。
(2)同周期自左向非金属性逐渐增强,金属性逐渐减弱。同主族自上而下金属性逐渐增强,非金属性逐渐减弱,所以化学性质最活泼的金属元素是K。最不活泼的是稀有气体元素Ar。同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,所以原子半径最小的是H。
(3)非金属性越强,最高价氧化物的水化物的酸性越强,则酸性最强的是高氯酸,化学式是HClO4。极易两性的是氢氧化铝,即化学式是Al(OH)3。
(4)元素④和⑤形成化合物是含有离子键的离子化合物氟化镁,电子式是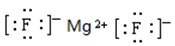 。元素⑦和⑨所形成化合物是含有离子键的离子化合物氯化钾,其形成过程是
。元素⑦和⑨所形成化合物是含有离子键的离子化合物氯化钾,其形成过程是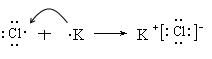 。
。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般