微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 据报道,已发现了第114号元素。下列关于其推测不正确的是(?)
A.它有+2,+3,+4价
B.其晶体有良好的导电性
C.其原子最外层上有4个电子
D.该元素位于第七周期ⅣA族
参考答案:A
本题解析:第七周期稀有气体原子序数为118,则118-114=4,所以该元素应位于第七周期118号元素前4纵行即ⅣA族。后依元素的周期律知该元素无+3价,所以A错。
本题难度:简单
2、填空题 (10分)X、Y、Z三种短周期元素,它们的原子序数之和为16 。X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如下图所示变化:
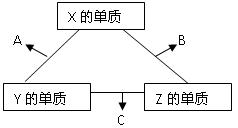
已知一个B分子中含有的Z元素的原子个数比C分子中的少一个。
请回答下列问题:
(1)X元素在周期表中的位置是______________________。
(2)X的单质与Z的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入__________(填物质名称);负极电极反应式为____________________。
(3)C在一定条件下反应生成A的化学方程式是_______________________________。
(4)已知Y的单质与Z的单质生成C的反应是可逆反应,△H<0。将等物质的量的Y、Z的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法中,正确的是____________________(填写下列各项的序号)。
a.达到化学平衡时,正反应速率与逆反应速率相等
b.反应过程中,Y的单质的体积分数始终为50%
c.达到化学平衡时,Y、Z的两种单质在混合气体中的物质的量之比为1:1
d.达到化学平衡的过程中,混合气体平均相对分子质量减小
e.达到化学平衡后,再升高温度,C的体积分数增大
参考答案:(10分)(1)第2周期,ⅥA族
(2)氧气;H2+2OH-=2H2O+2e-
(3)4NH3+5O2 4NO+6H2O
4NO+6H2O
(4)a b(每空2分,共10分)
本题解析:略
本题难度:简单
3、选择题

A.原子半径:Y>Z>W
B.XW2熔点为—107℃,沸点为12.5℃,说明固态XW2为分子晶体
C.YW3水溶液蒸干并灼烧可得YW3固体
D.ZW2分子结构如右图,说明ZW2是极性分子
参考答案:C
本题解析:本题考查原子结构和元素周期表,中等题。解题的突破口是“X原子的最外层电子数与次外层电子数相等”,短周期中只有Be和Ar,此处显然是Be,又因4种元素中有两种是金属,且X与W、Y与Z这两对原子的最外层电子数之和均为9,故可推出W为Cl、Y为Al、Z为S。由此可对照各选项作出判断:因AlCl3水解且其水解产物HCl易挥发,所以蒸干时得到的是Al(OH)3,再灼烧得Al2O3,故C错误;A、B、D均正确。
本题难度:一般
4、填空题 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B,C形成电子总数为10的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数为18的气体分子。请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关);
(1)A~F六种元素原子,原子半径最大的是?(填元素符号),B元素在元素周期表中的位置?。
(2)D与E可形成化合物D2E,该化合物的电子式为?。
(3)A、C、E三种元素形成的一种常见化合物,其浓溶液在加热条件下可与碳反应,该反应的化学方程式为? ________________________________。
(4)比较E、F气态氢化物的稳定性:? >?(用分子式表示)。
(5)请写出:CH3OH和O2与KOH溶液组成的燃料电池总反应式:?。
参考答案:(1)Na? 1分?第二周期VA族? 2分
(2)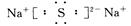
(3)Cu +2H2SO4(浓)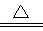 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(4)HCl>H2S?
(5)2CH3OH+3O2+4OH-=2CO32-+6H2O
本题解析:由A、C形成的化合物常温下为液态,猜测其为H2O,A是H,C 是O,故B是N,E是S,D是Na ,F 是Cl。
(1)原子半径最大的是钠,N元素在元素周期表中的位置是第二周期VA族。
(2)D(Na)与E(S)可形成化合物为Na2S,电子式为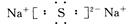 ,属于离子晶体。
,属于离子晶体。
(3)A(H)、C(O)、E(S)三种元素形成的一种常见化合物,其浓溶液是浓硫酸。所以与铜的化学方程式是Cu +2H2SO4(浓) CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
(4)E(S)、F(Cl)气态氢化物分别是H2S、HCl,同一周期,气态氢化物的稳定性逐渐增强,所以HCl>H2S。
(5)CH3OH和O2反应的化学方程式是: 2CH3OH+3O2=2CO2+4H2O?① 电解质溶液为KOH溶液,CH3OH反应生成的CO2会和KOH反应,CO2+2KOH=K2CO3+H2O?②
①+②×2,得:甲醇燃料电池的总化学反应为:2CH3OH+3O2+4KOH=6H2O+2K2CO3
总离子反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O
本题难度:困难
5、选择题 下列叙述正确的是(?)
A.SO2的水溶液能够导电,但SO2是非电解质
B.饱和氯水的导电性很好,所以氯气是强电解质
C.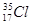 和
和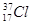 为不同的核素,二者核外电子数不同
为不同的核素,二者核外电子数不同
D.化合反应和分解反应一定属于氧化还原反应
参考答案:A
本题解析:选项A:在水溶液或熔融状态下能够导电的化合物叫做电解质。SO2水溶液导电是由于生成亚硫酸,而不是二氧化硫本身导电;选项B:电解质的强弱是否完全电离,与其导电性和溶解性无关,而电解质的导电性与温度,离子浓度和离子电荷数有关,所以这两者没必然联系;选项C:同一种同位素的不同核素具有相同的质子数和核外电子数,而具有不同的中子数;选项D:在反应过程中有元素化合价变化的化学反应叫做氧化还原反应,化合反应和分解反应不一定都是氧化还原反应。故选A
点评:核素是指具有一定数目质子和一定数目中子的一种原子,容易与同位素混淆;电解质的导电性与强弱电解质没有直接关系。对这些一易混淆的概念首先要清楚理解概念,并多加练习。
本题难度:简单