微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (11分)由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用钢材镀铝。工艺流程如下:

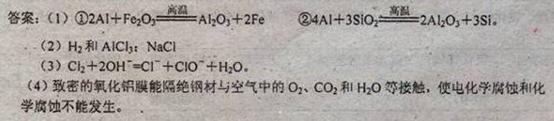
(1)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为①__?__和②?。
(2)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除Cl2外还含有?;固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在?。
(3)在用废碱液处理A的过程中,所发生反应的离子方程式为?。
(4)钢材镀铝后,表面形成的致密氧化铝膜能防止钢材腐蚀,其原因是?____。
参考答案:
本题解析:

本题难度:一般
2、选择题 新型镁合金被大量应用于制成笔记本电脑外壳、竞赛自行车框架等,这说明镁合金具有的优异性能是:①熔点低②硬度大③延展性好④导电性强⑤密度小⑥耐腐蚀?
A.①②③
B.②③④
C.①③⑥
D.②⑤⑥?
参考答案:D
本题解析:略
本题难度:简单
3、简答题 制备氮化镁的装置示意图如图所示:

回答下列问题:
(1)检查装置气密性的方法是______,a的名称是______,b的名称是______;
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式______;
(3)C的作用是______,D的作用是______,是否可以把C和D的位置对调并说明理由______;
(4)写出E中发生反应的化学方程式______;
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现象______.
参考答案:(1)利用装置内气体热胀冷缩检验装置的气密性,检查装置气密性的方法是:微热b,这时G中有气泡冒出,停止加热冷却后,G中插在溶液里的玻璃管形成一段水柱,则气密性良好;
由图中仪器结构可知,a为分液漏斗、b为圆底烧瓶,
故答案为:微热b,这时G中有气泡冒出,停止加热冷却后,G中插在溶液里的玻璃管形成一段水柱,则气密性良好;分液漏斗;圆底烧瓶;
(2)NaNO2和(NH4)2SO4反应生成氮气、硫酸钠与水,配平后方程式为:2NaNO2+(NH4)2SO4?△?.?2N2↑+Na2SO4+4H2O,
故答案为:2NaNO2+(NH4)2SO4?△?.?2N2↑+Na2SO4+4H2O;
(3)装置内含有氧气、反应生成的气体中可能含有氮的氧化物,装置C除去氧气(及氮氧化物)、D干燥氮气,除去水蒸气,防止对E装置反应的影响;
C、D对调后无法除去水蒸气,故C、D不能对调,
故答案为:除去氧气(及氮氧化物);除去水蒸气;不能,对调后无法除去水蒸气;
(4)装置E中氮气与镁反应生成二氮化三镁,反应方程式为:N2+3Mg?△?.?Mg3N2,
故答案为:N2+3Mg?△?.?Mg3N2;
(5)取少量产物于试管中,加入少量蒸馏水,试管底部有沉淀生成,可闻到刺激性氨味(把湿润的红色石蕊试纸放在管口,试纸变蓝),证明产物中含有氮化镁;
弃去上清液,加入盐酸,若观察到有气泡产生,则证明产物中含有未反应的镁,
故答案为:取少量产物于试管中,加入少量蒸馏水,试管底部有沉淀生成,可闻到刺激性氨味(把湿润的红色石蕊试纸放在管口,试纸变蓝),证明产物中含有氮化镁;弃去上清液,加入盐酸,若观察到有气泡产生,则证明产物中含有未反应的镁.
本题解析:
本题难度:一般
4、选择题 下列物质既能与盐酸反应放出气体,又能与氢氧化钠溶液反应放出气体的是
A.Al
B.Al2O3
C.Al(OH)3
D.NaHCO3
参考答案:A
本题解析:既能与盐酸反应放出气体又能与氢氧化钠溶液反应放出气体的是两性金属。Al是两性金属,所以答案选A。
点评:本题非常基础简单。
本题难度:简单
5、填空题 现有100mL AlCl3与MgSO4的混合溶液,分成两等份。
(1)向其中一份中加入10mL 4mol/L的氨水,恰好完全反应,其中AlCl3与氨水反应的离子方程式是?。继续加入l mol/L NaOH溶液至10mL时,沉淀不再减少,沉淀减少的离子方程式是?,剩余的沉淀的物质的量是?。
(2)向另一份中加入a mL 0.1mol/LBaCl2溶液能使SO 91exam .org42-沉淀完全,a=?。
参考答案:(8分)
(1)A13++3NH3·H2O=Al(OH)3↓+3NH4+(2分)
Al(OH)3+4OH-= [Al(OH)4]-(2分)
0.005 mol(2分)
(2)50(2分)
本题解析:(1)AlCl3与MgSO4的混合溶液都和氨水发生反应生成沉淀Al(OH)3和Mg(OH)2,且沉淀与氨水不再反应,AlCl3与氨水反应的离子方程式是A13++3NH3·H2O=Al(OH)3↓+3NH4+。10mL 4mol/L 的氨水,物质的量为0.01L×4 mol/L=0.04mol。
Al(OH)3会和NaOH溶液反应,沉淀减少,离子方程式为Al(OH)3+4OH-= [Al(OH)4]-。加入的NaOH的物质的量为l mol/L×0.01L=0.01mol,即AlCl3的物质的量为0.01mol。MgSO4为0.005mol。
根据化学方程式的计算,剩余的沉淀即Mg(OH)2的物质的量是0.005 mol。
(2)MgSO4为0.005mol,根据质量守恒定律及化学方程式的计算得,SO42-的物质的量也为0.005mol,故a=50。
点评:本题考查金属镁、金属铝的化合物的有关性质,注意氢氧化铝能和强碱反应是解题的关键所在,难度中。
本题难度:一般