微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知A(s)+2B(g)  2C(g)+D(g)?△H<0 在一密闭容器中反应的υ-t图。t1时,改变了一个条件,下列叙述正确的是
2C(g)+D(g)?△H<0 在一密闭容器中反应的υ-t图。t1时,改变了一个条件,下列叙述正确的是
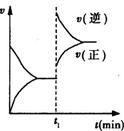
A.t1时,一定是升高了反应的温度
B.t1时,可能是向容器中通入了一定量的C气体
C.t1时,可能是向容器中加入了催化剂
D.t1时改变外界条件后,该反应的平衡常数可能减小,也可能不变
参考答案:D
本题解析:A、A(s)+2B(g)  2C(g)+D(g)?△H<0,是放热反应,升高温度,平衡逆向移动,本反应又是气体体积减小的反应,加压后,平衡也逆向移动,A有两种可能,升高温度,增大压强,A错误;B、通入一定量的C气体,正速率应从原平衡开始变大,B错误;C、向容器中加入催化剂,正逆反应速度均增大,且变化量相同,C不正确;D、如是升高温度,平衡逆向移动,平衡常数变小,如是加压后,平衡也逆向移动,平衡常数不变,D正确,选D。
2C(g)+D(g)?△H<0,是放热反应,升高温度,平衡逆向移动,本反应又是气体体积减小的反应,加压后,平衡也逆向移动,A有两种可能,升高温度,增大压强,A错误;B、通入一定量的C气体,正速率应从原平衡开始变大,B错误;C、向容器中加入催化剂,正逆反应速度均增大,且变化量相同,C不正确;D、如是升高温度,平衡逆向移动,平衡常数变小,如是加压后,平衡也逆向移动,平衡常数不变,D正确,选D。
本题难度:一般
2、选择题 将5 mol O2在高温下放电,经过时间t后建立了3O2 2O3的平衡体系,已知O2的转化率为20%,下列浓度(c)变化曲线正确的是(? )
2O3的平衡体系,已知O2的转化率为20%,下列浓度(c)变化曲线正确的是(? )
参考答案:C
本题解析:由于该可逆反应是从O2开始时,故起始时O3的浓度应为0。随反应的进行,O2的浓度越来越小,其反应速率也越来越慢,而生成物中的O3的浓度越来越大。当O2的转化率达到20%时,反应达到平衡,则O2和O3的浓度不再发生变化,但平衡时,O2的浓度比O3的浓度大,故只有C图符合题意。
本题难度:简单
3、计算题 某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。
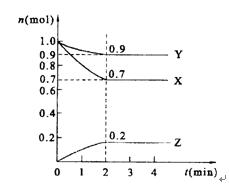
(1)反应物为?和??,生成物为?
(2)由图中所给数据进行分析,该反应的化学方程式为?;
(3)反应从开始至2min末,用Z的浓度变化表示的平均反应速率为v(Z)=?,
(4)当反应进行了3 min,该反应是否达到平衡?(填是或否)
参考答案:(1)Y? X? Z?(3分)?(2)Y + 3X?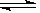 ?2Z(2分)
?2Z(2分)
(3)0.05 mol/(L·min)?(2分)(4)是(1分)
本题解析:由图可知,反应开始时,X、Y的量逐渐减小,而Z从0开始逐渐增多,但到2 min时,各物质的量不再改变,说明可逆反应此时达到了平衡状态。其中各物质的△n之比即方程式的系数比。
本题难度:一般
4、选择题 一定条件下,在密闭容器中,能表示反应X(g)+2Y(g)  2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓 度不再发生变化
度不再发生变化
③容器中的压强不再发生变化 ? ④单位时间内生成n mol Z,同时生成2n mol Y
A.①②
B.①④
C.②③
D.③④
参考答案:C
本题解析:略
本题难度:一般
5、选择题 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.在一恒温恒压的密闭容器里充入2mol?N2和8mol?H2达到平衡时生成1mol?NH3.现在相同条件下的同一容器中充入xmol?N2,ymol?H2和2mol?NH3,达到平衡时,NH3的质量分数与原来相同,且放出热量46.2kJ.则x、y的值为( )
A.1.5,6.5
B.2,8
C.5,21
D.3,13
参考答案:N2(g)+3H2(g)?2NH3(g)
开始2? 8? 0
转化0.5?1.5? 1
平衡1.5? ?6.5?1
氮气的转化率为0.5mol2mol×100%=25%,放出热量为46.2kJ;
相同条件下的同一容器中充入xmol?N2,ymol?H2和2mol?NH3,达到平衡时,NH3的质量分数与原来相同,且放出热量46.2kJ,
则二者为等效平衡,所以
? ?N2(g)+3H2(g)?2NH3(g)
开始x?y? 2
等效x+1? y+3
则x+1y+3=2mol8mol=14,
解得4x+1=y,
A.4×1.5+1≠6.5,故A错误;
B.4×2+1≠8,故B错误;
C.5×4+1=21,由放出的热量设氮气转化nmol,则92.4n-92.4=46.2,所以n=1.5mol,氮气的转化率为25%,故C正确;
D.3×4+1=13,由放出的热量设氮气转化nmol,则92.4n-92.4=46.2,所以n=1.5mol,氮气的转化率为37.5%,故D错误;
故选C.
本题解析:
本题难度:一般