微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (14分)铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是________________________。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是________;
A.Mg2+ B.Fe2+? C.Al3+? D.Cu2+
(3)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:

回答下列问题:
①操作Ⅰ的名称是________,操作Ⅱ的名称是________。
②写出在空气中煅烧FeCO3的化学方程式?;
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O)。
a.称取2.850g绿矾(FeSO4·7H2O)产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需_____________________________________________。
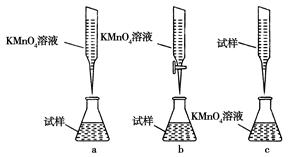
②某同学设计的下列滴定方式,最合理的是________。(夹持部分略去)(填字母序号)
③计算上述样品中FeSO4·7H2O的质量分数为?。
参考答案:(14分)(1)Fe2+、Fe3+、H+ (2)B、C
(3)①过滤(1分) 洗涤(1分) ②4FeCO3+O2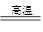 2Fe2O3+4CO2
2Fe2O3+4CO2
(4)①250 mL容量瓶 ②b ③0.975(其余均为2分)
本题解析:(1)磁性的固体Y应该是四氧化三铁,所以与足量盐酸反应后,溶液中的阳离子分别是Fe2+、Fe3+、H+。
(2)氢氧化钠是过量的,因此得不到氢氧化铝沉淀。又因为氢氧化亚铁极易被氧化生成氢氧化铁,所以滤渣应该是氢氧化铁、氢氧化镁和氢氧化铜。滤渣灼烧后生成氧化铁、氧化镁和氧化铜,与足量盐酸反应生成氯化铁、氯化镁和氯化铜,因此所得溶液与原溶液相比,溶液中大量减少的阳离子是Fe2+、Al3+,即答案选BC。
(3)①滤渣从溶液中分离出的方法是过滤,即操作I的名称是过滤。碳酸亚铁沉淀在烘干、煅烧之前必须进行洗涤,所以操作Ⅱ的名称是洗涤。
②由于亚铁离子极易被氧化,所以在空气中煅烧碳酸亚铁的的化学方程式是4FeCO3+O2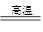 2Fe2O3+4CO2。
2Fe2O3+4CO2。
(4)①由于是配制250ml溶液,所以还需要250 mL容量瓶。
②样品的水溶液是显酸性的,应该用酸式滴定管。同样高锰酸钾溶液具有强氧化性,也应该用酸式滴定管,所以答案选b。
③根据5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O可知,25ml溶液中含有的亚铁离子的物质的量是0.01000mol/L×0.02L×5=0.001mol,则FeSO4·7H2O的质量0.001mol×278g/mol×10=2.78g,所以样品中FeSO4·7H2O的质量分数为2.78g÷2.850g=0.975,即97.5%。
本题难度:一般
2、选择题 人们习惯上把金、银、铜、铁、锡五种金属统称为“五金”;有一年很多地方的葡萄都减产甚至绝收,而法国小镇波尔多因为葡萄树都涂上了CuSO4与Ca(OH)2所以获得了大丰收。以下分析正确的是
A.CuSO4与Ca(OH)2含有葡萄生长所需的微量元素
B.CuSO4与Ca(OH)2混合物是化学肥料
C.Cu2+和碱可以使蛋白质变性,能杀死病菌,可以防治病虫害
D.CuSO4与Ca(OH)2混合物是有机农药,可以防治病虫害
参考答案:C
本题解析:强碱、重金属均可使蛋白质变性,能杀死病菌,可以防治病虫害,答案为C
本题难度:一般
3、填空题 (10分)下图是研究铜与浓硫酸的反应装置:
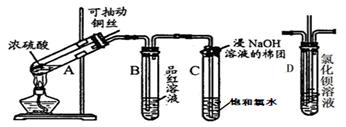
(1)A试管中发生反应的化学方程式为?。
(2)反应一段时间后,可观察到B试管中的现象为?。
(3)C试管口浸有NaOH溶液的棉团作用是?。
(4)实验结束后,证明A试管中反应所得产物是否含有铜离子的操作方法是?。
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
资料1
| 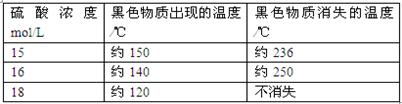
附表铜与浓硫酸反应产生黑色物质的相关性质
|
资料2
| X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。
|
?仅由上述资料可得出的正确结论是?。
A.铜与浓硫酸反应时所涉及的反应可能不止一个 B.硫酸浓度选择适当,可避免最后产物中出现黑色物质;C.该反应发生的条件之一是硫酸浓度≥15 mol·L D.硫酸浓度越大,黑色物质越快出现、越难消失
参考答案:(1)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O?;(2)溶液由红色变成无色
CuSO4+SO2↑+2H2O?;(2)溶液由红色变成无色
(3)吸收Cl2和SO2,防止污染空气;(4)向上拉铜丝,终止反应,冷却后,将A中溶液慢慢倒入盛有少量水的烧杯(试管)里,观察溶液颜色是否为蓝色;(5)A、B、D
本题解析:(1)在A试管中Cu与热的浓硫酸发生反应:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O?;(2)由于反应产生了SO2气体;该气体由漂白性,能使品红溶液褪色。因此反应一段时间后,可观察到B试管中品红溶液由红色变为无色。(3)Cl2、SO2气体容易导致大气污染,因为SO2和Cl2气体是酸性气体,所以在C试管口用浸有NaOH溶液的棉团来吸收扩散的SO2和 Cl2气体。在C试管中发生反应:Cl2+SO2+2H2O=H2SO4+2HCl。(4)实验结束后,若要证明A试管中反应所得产物含有铜离子,操作方法是向上拉铜丝,终止反应,冷却后,将A中溶液慢慢倒入盛有少量水的烧杯(试管)里,观察溶液颜色是否为蓝色;(5)根据资料提供的信息可知:铜与浓硫酸反应时所涉及的反应可能不止一个;若硫酸浓度选择适当,可避免最后产物中出现黑色物质;硫酸浓度越大,黑色物质越快出现、越难消失。至于硫酸的浓度是多少不容易确定。因此正确选项是A、B、D。
CuSO4+SO2↑+2H2O?;(2)由于反应产生了SO2气体;该气体由漂白性,能使品红溶液褪色。因此反应一段时间后,可观察到B试管中品红溶液由红色变为无色。(3)Cl2、SO2气体容易导致大气污染,因为SO2和Cl2气体是酸性气体,所以在C试管口用浸有NaOH溶液的棉团来吸收扩散的SO2和 Cl2气体。在C试管中发生反应:Cl2+SO2+2H2O=H2SO4+2HCl。(4)实验结束后,若要证明A试管中反应所得产物含有铜离子,操作方法是向上拉铜丝,终止反应,冷却后,将A中溶液慢慢倒入盛有少量水的烧杯(试管)里,观察溶液颜色是否为蓝色;(5)根据资料提供的信息可知:铜与浓硫酸反应时所涉及的反应可能不止一个;若硫酸浓度选择适当,可避免最后产物中出现黑色物质;硫酸浓度越大,黑色物质越快出现、越难消失。至于硫酸的浓度是多少不容易确定。因此正确选项是A、B、D。
本题难度:一般
4、计算题 为测定某铜银合金的成分,将30.0g合金溶于80mL13.5mol/L的浓HNO3中,将合金完全溶解后,收集到气体6.72L(标准状况),并测得溶液的pH=0,假设反应后溶液的体积仍为80mL,试计算:
(1)被还原的HNO3的物质的量。
(2)合金中Ag的质量分数。
参考答案:
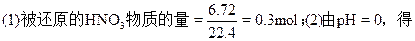
[H+]=1mol/L。
所以,参加反应的HNO3总物质的量=(13.5-1)×0.08=1mol。
设:合金含Agxg,含Cu(30-x)g则
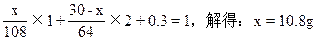
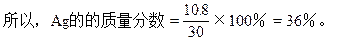
本题解析:本题解题关键在于把握Cu,Ag与浓HNO3反应过程中,隐含了浓HNO3稀释的计算实质,即所涉及的反应有四个:
Ag+2HNO3(浓)====AgNO3+NO2↑+H2O? (1)
Cu+4HNO3(浓)====Cu(NO3)2+2NO2↑+2H2O? (2)
3Ag+HNO3(稀)====3AgNO3+NO↑+2H2O? (3)
3Cu+8HNO3(稀)====3Cu(NO3)2+2NO↑+4H2O? (4)
采取对反应体系的始态与终态进行整体分析,利用守恒法则可获得十分简捷的计算。
观察四个化学方程式,不难看出:被还原的HNO3均转化成NO和NO2,根据N原子数守恒分析,被还原的硝酸的物质的量等于NO与NO2物质的量之和。从已知的NO与NO2的总体积进而可求得被还原的HNO3的量。
从HNO3的作用分析:消耗HNO3的总物质的量等于被还原HNO3与只起酸性作用的HNO3物质的量之和。由化学式AgNO3和Cu(NO3)2,可将只做酸用的HNO3量以Ag和Cu的物质的量代换,即:
n(HNO3)====n(NO+NO2)+n(Ag)+2n(Cu)
据此可简捷地求得Ag的质量分数。
本题难度:一般
5、实验题 某校化学兴趣小组为探究铁与浓硫酸的反应,设计了图1、图2所示装置进行实验。
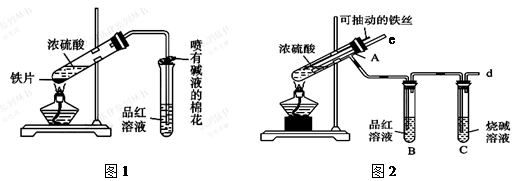
(1)能说明有SO2气体产生的实验现象是?。
(2)图2中导气管e的主要作用为?。
(3)上述装置中图2中的NaOH溶液能吸收SO2尾气,防止污染,如将其更换为酸性KMnO4溶液,同样可以达到目的,试写出酸性KMnO4溶液与SO2反应的化学方程式:
?。
(4)对比两套实验装置,不难发现图2装置除了能更好的吸收有毒气体SO2防止其污染环境外,还有一个非常明显的优点,你认为是?。
(5)反应一段时间后停止反应,待冷却后用胶头滴管吸取A试管中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;?Ⅲ:既有Fe3+又有Fe2+。
为确认溶液的成分,选用如下试剂:
A.稀HCl溶液
B.稀硫酸
C.KSCN溶液
D.酸性KMnO4溶液