微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在10℃时某化学反应速率为0.1mol/(L·s),若温度每升高10℃反应速率增加到原来的2倍。为了把该反应速率提高到1.6?mol/(L·s),则该反应需在什么温度下进行
A.30℃
B.40℃
C.50℃
D.60℃
参考答案:C
本题解析:2n=1.6/0.1? n=4,所以为50℃
本题难度:困难
2、选择题 将4mol A气体和2mol B气体在2L的密闭容器中混合,并在一定条件下发生如下可逆反应:2A(g) + B(g) 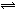 ?2C(g)。若经2s后测得C的浓度为0.6 mol/L,现有下列几种说法,其中正确的是(?)
?2C(g)。若经2s后测得C的浓度为0.6 mol/L,现有下列几种说法,其中正确的是(?)
A.反应达到平衡时,A、B、C的浓度不再变化,反应停止
B.升高温度、增大压强、增加A的浓度、减小C的浓度或使用催化剂等都可以使反应速率加快
C.经过足够长时间后,A和B可以完全转化为C
D.2s时物质A转化了1.2mol
参考答案:D
本题解析:A、反应达到平衡时,A、B、C的浓度不再变化,化学平衡是动态平衡,反应仍在继续,故A错误;
B、减小浓度,反应速率减小,故B错误;
C、反应是可逆反应,反应物不能全部转化为生成物,故C错误。
故选D。
点评:本题考查了化学平衡状态的判断及外界条件对化学平衡的影响,难度不大,注意反应达到平衡状态时,正逆反应速率相等但不等于0。
本题难度:简单
3、选择题 一定温度下,把2. 0体积的N2和6. 0体积的H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通,容器中发生如下反应:N2+3H2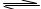 2NH3。已知平衡时NH3的浓度是c mol·L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为c mol·L-1的是
2NH3。已知平衡时NH3的浓度是c mol·L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为c mol·L-1的是
A.1.0体积的N2和3.0体积的H2
B.2.0体积的N2、6.0体积的H2和4.0体积的NH3
C.4.0体积的NH3和1.0体积的H2
D.2.0体积的NH3
参考答案:C
本题解析:在等温等压情况下的等效平衡,只要求反应物的量担按系数比转化为半边后,两反应物的量的比例符合1:3即可。
本题难度:一般
4、选择题 下列说法正确的是?
①参加反应的物质的性质是影响化学反应速率的主要因素②光是影响某些化学反应速率的外界条件之一③决定化学反应速率的主要因素是浓度 ④不管什么反应,增大浓度,或加热或加压,或使用催化剂,都可以加快反应速率
A.①②
B.②③
C.③④
D.①④
参考答案:A
本题解析:①正确,影响化学反应速率的主要因素是反应物本身的性质;②正确,光为影响反应速率的外因;③错,决定化学反应速率的主要因素为反应物本身性质;④错,压强只能影响有气体参加的反应,对于固体或液体来说,受压强影响很小。
本题难度:简单
5、计算题 (10分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生可逆反应:N2(g)+3H2(g) ="====" 2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)="13" mol,nt(NH3)="6" mol,计算a的值。
(2)反应达到平衡时,混合气体的体积为716.8 L(标准状况下),其中NH3的含量(体积分数)为25%,计算平衡时N2 的转化率。
参考答案:(10分)(1)a="16?" (2) N2转化率=25%
本题解析:略
本题难度:一般