微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (11分)某实验小组的同学为探究一氧化氮的性质,欲选用下列实验装置来制取一氧化氮。

A? B? C ?D
请回答下列问题:
(1)用上图中所示的装置制取一氧化氮,选用仪器连接的顺序应是A接_________。
(2)现欲用15 mol/L HNO3溶液配制500 mL、1 mol/L HNO3溶液时,要用到的仪器除烧杯、胶头滴管、玻璃棒、量筒外,还必须使用的一种玻璃仪器是?。
(3)稀硝酸具有强氧化性,在常温下就可以和铜发生反应生成一氧化氮气体,写出该反应的化学方程式:___________________________________________________。
(4)实验开始时,该小组同学发现在烧瓶中有红棕色气体产生,请你用化学方程式来表示产生这种现象的原因:_________________________________________________。
(5)一氧化氮和一氧化碳是汽车尾气中的主要污染物。目前,汽车尾气已成为许多大城市空气的主要污染源。治理汽车尾气中的NO和CO的一种方法是:在汽车的排气管上装一个催化转化装置,使NO与CO反应,生成CO2和N2。反应的化学方程式是?。
参考答案:(1)B (2)容量瓶(3)3Cu +8HNO3==3Cu(NO3)2 +2NO +4H2O
(4)2NO +O2==2NO2(5)2NO+2CO==2CO2+N2
本题解析:(1)NO不溶于水且易与空气中的氧气反应,故只能用排水法收集,仪器连接的顺序应是A接B。
(2)配制物质的量浓度一定的溶液,需玻璃仪器:烧杯、胶头滴管、玻璃棒、量筒、容量瓶等。故还必须使用的一种玻璃仪器是容量瓶。
(3)稀硝酸和铜反应方程式:3Cu +8HNO3==3Cu(NO3)2 +2NO +4H2O
(4)烧瓶中有红棕色气体产生是因为NO与装置内原有的氧气反应生成NO2反应。反应方程式2NO +O2==2NO2
(5)根据题意反应方程式为:2NO+2CO==2CO2+N2
点评:本题考查了NO的制取原理、收集方法、性质,还有溶液的配制。综合性较强。
本题难度:一般
2、选择题 以下物质的实验室制备不合理的是
A.用铅皿制备HF
B.用浓硫酸制备HI
C.用磨砂接口的装置制备HNO3
D.用饱和食盐水代替水制备乙炔
参考答案:A
本题解析:A、氟化氢是具有强氧化性的弱酸,可以腐蚀玻璃,在铅皿中制取不和铅发生反应,故A正确;B、浓硫酸具有强氧化性,能氧化碘化氢,不能用来制备碘化氢,故B错误;C、硝酸具有强氧化性腐蚀橡胶管,所以用磨砂接口的装置制备HNO3,故C正确;D、如果改用氯化钠的饱和溶液,则在相同的体积中水的含量变少了,从而达到降低反应速率的目的,故D正确;故选B.
本题难度:一般
3、选择题 检验Cl2是否充满了集气瓶的正确操作为
[? ]
A.用玻璃棒粘上湿润的碘化钾淀粉试纸伸到集气瓶口附近,观察试纸是否变蓝
B.将AgNO3溶液滴入集气瓶中.观察有无白色沉淀生成
C.用玻璃棒蘸取少许NaOH溶液放人集气瓶口附近,看是否反应
D.用手将湿润的碘化钾淀粉试纸放在集气瓶口上方,观察颜色是否变蓝
参考答案:A
本题解析:
本题难度:简单
4、选择题 下列关于层析实验的说法正确的是:
A.点样后应在滤纸上形成一个直径较大的样斑,便于实验时观察
B.展开剂可以既是流动相又是固定相
C.为使层析实验有较好的分离效果,试样溶液浓度应较小
D.纸层析法简称纸层析,是色谱分析法的一种
参考答案:D
本题解析:A不正确,点样的目的是对照试验。展开剂可以只能是流动相,B不正确。流动相溶剂对分离物质有适当的溶解度,太大或太小均是错误的。所以正确的答案选D。
本题难度:简单
5、实验题 实验室制取少量溴乙烷的装置如右图所示。根据题意完成下列填空:
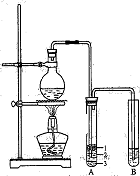
⑴圆底烧瓶中加入的反应物是溴化钠、?和1:1的硫酸。配制体积比1:1的硫酸所用的定量仪器为? (选填编号)。?
a.天平? b.量筒? c.容量瓶? d.滴定管
b.⑵试管A中除了产物和水之外,还可能存在?、?(写出化学式)。
⑶将生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是?。
试管A中的物质分为三层(如图所示),产物在第?层。
⑷写出加热时烧瓶中发生的主要反应的化学方程 式:?。
⑸用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质的正确方法是:
? (选填编号)。?
a.蒸馏? b.氢氧化钠溶液洗涤? c.用四氯化碳萃取? d.用亚硫酸钠溶液洗涤
若试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是?。
⑹实验员老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是:?。
参考答案:(12分)
⑴ 乙醇?(1分), b (1分)
⑵ HBr 、C2H5OH (1分)
⑶ 冷却、液封溴乙烷?。(1分)
3 。(1分)
(4) NaBr+H2SO4═HBr+NaHSO4? ;(2分)
HBr+CH3CH2OH  ?CH3CH2Br+H2O(2分)
?CH3CH2Br+H2O(2分)
⑸? d?(1分)
乙烯 (1分)。
⑹ 反应可能会产生Br2,腐蚀橡胶(1分)
本题解析:(1)实验室制取少量溴乙烷所用试剂是乙醇和溴化氢反应,二者在加热下发生取代反应生成溴乙烷;此实验量取溶液的体积要求精确度不是很高,可用量筒量取,故答案为:乙醇; b;
(2)药品混合后在加热条件下生成HBr并和乙醇发生取代反应,故答案为:NaBr+H2SO4═HBr+NaHSO4、HBr+CH3CH2OH  CH3CH2Br+H2O;
CH3CH2Br+H2O;
(3)收集装置所用导气管较长,可以起到冷却的作用,生成的溴乙烷和水互不相溶,并且溴乙烷的密度比水大,在冰水混合物的下层,故答案为:冷却、液封溴乙烷; 3;
(4)在加热条件下反应,HBr和CH3CH2OH都易挥发,故生成物中有存在HBr、CH3CH2OH,故答案为:HBr;CH3CH2OH;
(5)试管A中获得的有机物呈棕黄色,是由于浓硫酸具有强氧化性,将HBr氧化物Br2,产物为溴乙烷,混有单质溴,蒸馏不能完全除去杂质,并且操作麻烦,氢氧化钠溶液易使溴乙烷水解,四氯化碳会引入新的杂质,而亚硫酸钠和溴发生氧化还原反应生成HBr和硫酸钠,易与溴乙烷分离.,在加热温度较高时,乙醇发生消去反应生成乙烯,
故答案为:d; 乙烯;
(6)浓硫酸具有强氧化性,将HBr氧化物Br2,生成的Br2具有强氧化性,会腐蚀橡胶,应用玻璃导管,故答案为:反应会产生Br2,腐蚀橡胶。
点评:本题主要考察溴乙烷大制备、提纯、有机反应等复杂性以及实验安全等.第1、2、3问,源于课本中对该演示实验的实验报告,特别是第6问中“标准玻璃接口”这一装置,如果没有认真研究过教材,就不会很熟悉该装置.建议同学们精心选择一些取之于教材,但又高于教材的习题.这类题的答案就在教材之中,若不重视教材就很难取得好成绩。
本题难度:一般