微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述中,正确的是
A.纯碱、烧碱均属于碱
B.凡能电离出H+的化合物均属于酸
C.CuSO4·5H2O属于纯净物
D.盐类物质一定含有金属阳离子
参考答案:C
本题解析:纯碱是碳酸钠,属于盐,A不正确;电离出的阳离子全部是氢离子的化合物是酸,B不正确;氯化铵等铵盐中不要含有金属阳离子,答案选C。
考点:考查物质的有关分类及判断
点评:本题容易错选B,主要是由于对概念的把握不准确导致,因此正确理解概念并能灵活运用是关键。
本题难度:困难
2、选择题 38Sr(锶)与37Rb(铷)是同周期的相邻元素,下列有关锶的说法错误的是
A.38Sr是第3周期ⅡA族元素
B.Sr的离子半径比Kr(氪)的原子半径大
C.Sr的碳酸盐受热会分解
D.Sr的氧化物对应水化物碱性比Rb的氧化物对应水化物碱性弱
参考答案:AB
本题解析:38Sr是第5周期元素,A不正确。Sr离子和Kr的核外电子排布相同,原子序数越大,微粒半径越小,锶的原子序数大于氪的,B不正确。同主族元素,性质相似,且自上而下金属性逐渐增强,所以C、D均正确。答案选AB。
本题难度:一般
3、选择题 以下各种表示式中,最能反映氮原子核外电子运动状态的是?(?)
A.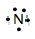
B.
C.1s22s22p3
D.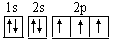
参考答案:D
本题解析:
A、只表示最外层;B、只表示分两个电子层;C、不能表示电子自旋方向;D、全面表示出电子的电子层、所在的能级、轨道、电子的自旋方向,D正确。
本题难度:简单
4、选择题 由于碘是卤素中原子半径较大的元素,可能呈现金属性。下列事实最能够说明这个结论的是? (? )
A.已经制得了 IBr、ICl 等卤素互化物
B.已经制得 I2O5 等碘的氧化物
C.已经制得了I (NO3)3、I (ClO4)3·2H2O等含 I3+ 离子化合物
D.碘(I2)易溶于KI等碘化物溶液,形成I3- 离子
参考答案:C
本题解析:要说明碘体现了金属性,就要证明它形成了阳离子,不能只是显正价(非金属在共价化合物中也可以显正价的),IBr、ICl是共价化合物,没有形成碘离子,所以不能说明;碘易溶于KI等碘化物溶液形成I3-离子也不能说明的;能形成离子化合物I(NO3)3才能说明碘的金属性。
本题难度:一般
5、选择题 根据下列电子排布,处于激发态的原子是
A.1s22s22p6
B.1s22s22p63s1
C.[Ar]3d14s2
D.1s22s23s1
参考答案:D
本题解析:原子的电子排布遵循构造原理,能使整个原子的能量处于最低状态,处于最低能量的原子叫基态原子,所以A、B、C都是基态原子,D原子没有排2p轨道直接排了3s轨道,不是能量最低,所以是激发态。答案选D。
点评:电子基态排布主要根据泡利原理和洪特规则。
本题难度:一般