微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述中,正确的是( )
A.在船舶的外壳装上铜块可防止其发生电化学腐蚀
B.MnO2、FeCl3和CuSO4都可加快H2O2的分解速率
C.FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3
D.用惰性电极分别电解CuCl2溶液和MgCl2溶液分别得到单质Cu和Mg
参考答案:A、铜和铁的活泼性不同,铜、铁和海水能构成原电池而加快铁的电化学腐蚀,故A错误.
B、二氧化锰、氯化铁和硫酸铜可作过氧化氢分解的催化剂,都能加快双氧水的分解,故B正确.
C、加热氯化铁溶液能加快氯化铁的水解生成氢氧化铁和盐酸,且生成的盐酸是挥发性酸,灼烧氢氧化铁,氢氧化铁分解生成氧化铁,所以如果将氯化铁溶液加热蒸干、灼烧得到Fe2O3;加热硫酸铁溶液,硫酸铁能水解生成氢氧化铁和硫酸,但硫酸不是挥发性酸,所以加热硫酸铁溶液最后得到的仍然是硫酸铁不是氧化铁,故C错误.
D、金属镁是活泼金属,所以应采用电解熔融态的盐而不是电解盐溶液,故D错误.
故选B
本题解析:
本题难度:一般
2、填空题 某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
实验编号
| H2C2O4溶液
| 酸性KMnO4溶液
| 温度
|
浓度(mol·L-1)
| 体积(mL)
| 浓度(mol·L-1)
| 体积 (mL)
|
①
| 0.10
| 2.0
| 0.010
| 4.0
| 25
|
②
| 0.20
| 2.0
| 0.010
| 4.0
| 25
|
③
| 0.20
| 2.0
| 0.010
| 4.0
| 50
|
?
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,每消耗1molH2C2O4转移_______mol电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4)∶n(KMnO4)≥______。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是________。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=________mol·L-1·min-1。
(4)已知实验③中c(MnO4-)~反应时间t的变化曲线如下图。若保持其他条件不变,请在图中画出实验②中c(MnO4-)~t的变化曲线示意图。

参考答案:(1)2 2.5(或5:2) ?(2)②和③, ①和② ?(3)0.010
(4)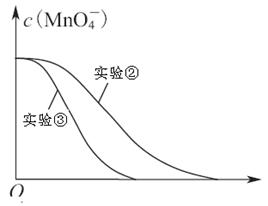
本题解析:(1)高锰酸钾溶液与草酸反应的化学方程式为:2KMnO4 + 5H2C2O4 + 3H2SO4 = K2SO4 + MnSO4 + 10CO2↑+ 8H2O,反应中C的化合价由+3价升高到+4价,所以每消耗1molH2C2O4转移2mol电子;为了观察到紫色褪去,则KMnO4必须完全反应,从方程式可看出:n(H2C2O4) n(KMnO4)≥5∶2。(2)分析表中数据可看出,②和③两个实验仅温度不同,①和②两个实验仅草酸浓度不同,所以探究温度对化学反应速率影响的实验是②和③,探究反应物浓度对化学反应速率影响的实验是①和②。(3)用KMnO4溶液表示的平均反应速率为: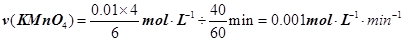 。(4)实验比较实验的反应温度低,则反应速率小,KMnO4溶液褪色时间长,c(MnO4-)~t的变化曲线示意图见答案。
。(4)实验比较实验的反应温度低,则反应速率小,KMnO4溶液褪色时间长,c(MnO4-)~t的变化曲线示意图见答案。
本题难度:一般
3、选择题 下列图示与对应叙述相符的是( )
A.

反应达到平衡后,升高温度,平衡常数K值变大
B.
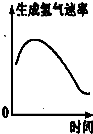
表示镁条放入盐酸中生成氢气速率随时间的变化
C.
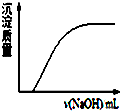
表示向Ca(HCO3)2溶液中滴入NaOH溶液所得沉淀的质量的变化
D.
表示纯碱溶液受热时氢氧根浓度随温度的变化
参考答案:A.由图象可知,反应物总能量大于生成物总能量,反应放热,升高温度平衡向逆反应方向移动,平衡向平衡常数K值减小,故A错误;
B.镁条放入盐酸中,反应放热,随着反应的进行,盐酸的浓度逐渐降低,则开始时反应速率增大,后来反应速率减小,故B正确;
C.向Ca(HCO3)2溶液中滴入NaOH溶液,反应为:HCO3-+OH-=CO32-+H2O,CO32-+Ca2+=CaCO3↓,则一开始就有沉淀生成,故C错误;
D.纯碱溶液受热时水解程度增大,OH-浓度增大,故D错误.
故选B.
本题解析:
本题难度:简单
4、选择题 在反应:C+CO2 2CO中,可使反应速率增大的措施是
2CO中,可使反应速率增大的措施是
①增大压强 ②升高温度 ③通入CO2 ④增加碳的量
A.①②③④
B.②③④
C.①②③
D.②③④