微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在托盘天平的两盘上,分别放有两个质量相同的烧杯,各盛有6mol/LHCl100mL,使天平达到平衡.分别向两烧杯中加入不超过5g的镁和铝,若要使其充分反应后天平仍保持平衡,则加入的镁与铝的质量之比为( )
A.1:1
B.24:27
C.12:9
D.32:33
参考答案:n(HCl)=0.01L×6mol/L=0.06mol,镁和铝的质量不超过5g,由反应Mg+2HCl=MgCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑可知,金属完全反应,盐酸足量,要使其充分反应后天平仍保持平衡,应保证托盘天平两个托盘中金属的质量与生成氢气的质量之差相等,
设镁的质量为x,铝的质量为y,
则Mg+2HCl=MgCl2+H2↑△m
24 22
托盘增重22x24,
2Al+6HCl=2AlCl3+3H2↑△m
5448
托盘增重48y54,
则22x24=48y54,
x:y=32:33,
故选D.
本题解析:
本题难度:一般
2、选择题 食盐、蔗糖、醋酸、纯碱、汽油、“84消毒液”等是日常生活中经常使用的物质,下列有关说法或表示正确的是
A.食盐中阴离子的核外电子排布结构示意图为: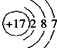
B.纯碱与汽油去除油污的原理相同
C.“84消毒液”中有效成分NaClO的电子式为: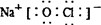
D.蔗糖与醋酸的最简式相同
参考答案:C
本题解析:A、食盐为NaCl,其阴离子为Cl–,Cl–核外电子数为18,核外电子排布式结构示意图为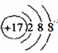 ,错误;B、纯碱去污原理是因为纯碱水解使溶液呈碱性,油污在碱性条件下水解,生成易溶于水的高级脂肪酸钠和甘油,而汽油能去污是因为汽油具有挥发性,汽油溶解油污,共同挥发,所以纯碱与汽油去除油污的原理不相同,错误;C、“84消毒液”中有效成分为NaClO,它是由钠离子和次氯酸根离子构成,电子式为:
,错误;B、纯碱去污原理是因为纯碱水解使溶液呈碱性,油污在碱性条件下水解,生成易溶于水的高级脂肪酸钠和甘油,而汽油能去污是因为汽油具有挥发性,汽油溶解油污,共同挥发,所以纯碱与汽油去除油污的原理不相同,错误;C、“84消毒液”中有效成分为NaClO,它是由钠离子和次氯酸根离子构成,电子式为: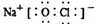 ,正确;D、蔗糖的分子式为C12H22O11,最简式为C12H22O11,醋酸的分子式C2H4O2,最简式为CH2O,两者的最简式不相同,错误。
,正确;D、蔗糖的分子式为C12H22O11,最简式为C12H22O11,醋酸的分子式C2H4O2,最简式为CH2O,两者的最简式不相同,错误。
本题难度:一般
3、选择题 下列说法中错误的是(?)
A.凡是氧化还原反应,都不可能是复分解反应
B.化合反应不可能是氧化还原反应
C.置换反应一定是氧化还原反应
D.分解反应可能是氧化还原反应
参考答案:B
本题解析:复分解反应一定不是氧化还原反应,A正确;有单质参加的化合反应是氧化还原反应,B不正确;一种单质和一种化合物反应生成另外一种单质和化合物的反应是置换反应,因此C正确,D也是正确的,有单质生成的分解反应也是氧化还原反应,答案选B。
点评:凡是有元素化合价升降的反应一定是氧化还原反应,所以准确标出有关元素的化合价是判断的关键。氧化还原反应和四种基本反应类型的关系可用如图来形象的表示
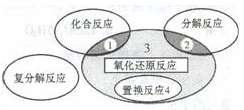 。
。
本题难度:一般
4、填空题 尿素[CO(NH2)2]是一种非常重要的高氮化肥,以天然气(含H2S)为原料合成尿素的主要步骤如下图所示(图中某些转化步骤未列出)。
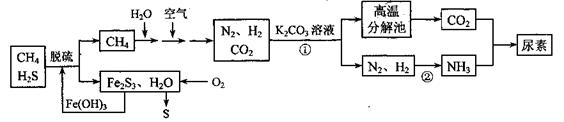
请回答下列问题:
(1)反应①的离子方程式是______________
(2)天然气脱硫后产生的Fe2S3和H2O与02反应的化学方程式是_______。
(3)反应②是放热反应,温度升高,该反应的平衡常数_______ (填 “增大”、“减小” 或“不变”)。H2NCOONH4(氨基甲酸铵)是合成尿素的中间体,其中碳原子的杂化轨道类型是_______杂化。
(4)如果整个生产过程釆用绿色化学工艺,则生产120t尿素理论上需要?CH4___m3 (标准状况)。
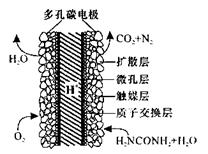
(5)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电。尿素燃料电池结构如图所示,工作时负极的电极反应式为__________
参考答案:(14分)
(1)CO32-+CO2+H2O=2HCO3-(2分)
(2)2Fe2S3+6H2O+3O2=4Fe(OH)3+6S(2分)
(3)减小(2分)? sp2(2分)?(4)4.48×104(3分)
(5)CO(NH2)2+H2O-6e-= N2↑+CO2↑+6H+(3分)
本题解析:(1)反应①发生二氧化碳与碳酸钾溶液反应生成碳酸氢钾,其离子反应为CO32-+CO2+H2O═2HCO3-;(2)Fe2S3和H2O与02反应生成氢氧化铁和S,该反应为2Fe2S3+6H2O+3O2═4Fe(OH)3+6S;(3)反应②为合成氨的反应,放热反应,温度升高,平衡逆向移动,则平衡常数K减小;H2NCOONH4中的C原子上没有孤对电子,成键数为3,C原子采取sp2杂化;(4)由C原子守恒可知,CH4~CO2~CO(NH2)2,则生产120t尿素理论上需要CH4为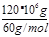 ×22.4L/mol×10-3m3=4.48×104m3;(5)尿素燃料电池中尿素再负极上失去电子生成氮气、二氧化碳,负极反应为CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+;
×22.4L/mol×10-3m3=4.48×104m3;(5)尿素燃料电池中尿素再负极上失去电子生成氮气、二氧化碳,负极反应为CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+;
本题难度:一般
5、填空题 (2分)钠原子的质量数为23,中子数为12,那么它的核外电子数是__________,质子数是__________。
参考答案:11? 11
本题解析:根据质量数=质子数+中子数及核外电子数=质子数知质子数、电子数均为11.
本题难度:简单